高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
矿物资源的综合利用有多种方法,如铅锌矿(主要成分为$\text{PbS}$、$\text{ZnS}$)的利用有火法和电解法等。
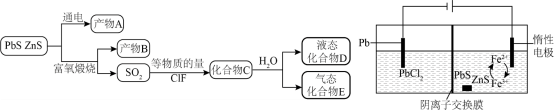
已知:①$\text{PbC}{{\text{l}}_{\text{2}}}\text{(s)}\underset{{冷却}}{\overset{{热水}}{\mathop{\rightleftharpoons }}}\,\text{PbC}{{\text{l}}_{\text{2}}}\text{(aq)}\underset{{}}{\overset{\text{HCl}}{\mathop{\rightleftharpoons }}}\,{{\text{H}}_{\text{2}}}\left[ \text{PbC}{{\text{l}}_{\text{4}}} \right]$;②电解前后$\text{ZnS}$总量不变;③$\text{AgF}$易溶于水。
请回答:
根据富氧煅烧(在空气流中煅烧)和通电电解(如图)的结果,$\text{PbS}$中硫元素体现的性质是 (选填“氧化性”、“还原性”、“酸性”、“热稳定性”之一)。产物$\rm B$中有少量$\text{P}{{\text{b}}_{3}}{{\text{O}}_{4}}$,该物质可溶于浓盐酸,$\text{Pb}$元素转化为${{\left[ \text{PbC}{{\text{l}}_{4}} \right]}^{2-}}$,写出该反应的化学方程式 ;从该反应液中提取$\text{PbC}{{\text{l}}_{2}}$的步骤如下:加热条件下,加入 (填一种反应试剂),充分反应,趁热过滤,冷却结晶,得到产品。
还原性;$\\rm Pb_{3}O_{4}+14HCl($浓$\\rm )=3{{\\text{H}}_{2}}\\left[ \\text{PbC}{{\\text{l}}_{4}} \\right]\\rm +4H_{2}O+Cl_{2}↑$;$\\rm PbO$或$\\rm Pb(OH)_{2}$或$\\rm PbCO_{3}$
"]]根据富氧煅烧和通电电解的结果,$\text{PbS}$中硫元素化合价升高,体现的性质是还原性。产物$\rm B$中有少量$\text{P}{{\text{b}}_{3}}{{\text{O}}_{4}}$,该物质可溶于浓盐酸,$\text{Pb}$元素转化为${{\left[ \text{PbC}{{\text{l}}_{4}} \right]}^{2-}}$,该反应的化学方程式:$\rm Pb_{3}O_{4}+14HCl($浓$\rm )=3{{\text{H}}_{2}}\left[ \text{PbC}{{\text{l}}_{4}} \right]\rm +4H_{2}O+Cl_{2}↑$;根据$\text{PbC}{{\text{l}}_{\text{2}}}\text{(s)}\underset{{冷却}}{\overset{{热水}}{\mathop{\rightleftharpoons }}}\,\text{PbC}{{\text{l}}_{\text{2}}}\text{(aq)}\underset{{}}{\overset{\text{HCl}}{\mathop{\rightleftharpoons }}}\,{{\text{H}}_{\text{2}}}\left[ \text{PbC}{{\text{l}}_{\text{4}}} \right]$可得反应:$\text{PbC}{{\text{l}}_{2}}\text{(aq)+2HCl}\rightleftharpoons {{\text{H}}_{2}}\left[ \text{PbC}{{\text{l}}_{4}} \right]$,要从该反应液中提取$\text{PbC}{{\text{l}}_{2}}$,则所加试剂应能消耗$\rm H^{+}$使平衡逆向移动,且不引入杂质,则步骤为:加热条件下,加入$\rm PbO$或$\rm Pb(OH)_{2}$或$\rm PbCO_{3}$,充分反应,趁热过滤,冷却结晶;
下列说法正确的是 。
电解池中发生的总反应是$\\text{PbS}=\\text{Pb+S}\\rm ($条件省略$\\rm )$
","产物$\\rm B$主要是铅氧化物与锌氧化物
","$\\text{1\\;\\rm mol}$化合物$\\rm C$在水溶液中最多可中和$2\\;\\rm mol\\text{ }NaOH$
","$\\text{ClF}$的氧化性弱于$\\text{C}{{\\text{l}}_{2}}$
"]$\rm A$. 根据图示和已知②可知,电解池中阳极上$\rm Fe^{2+}$生成$\rm Fe^{3+}$,$\rm Fe^{3+}$氧化$\rm PbS$生成$\rm S$、$\rm Pb^{2+}$和$\rm Fe^{2+}$,阴极上$\rm PbCl_{2}$生成$\rm Pb$,发生的总反应是:$\text{PbS}=\text{Pb+S}\rm ($条件省略$\rm )$,$\rm A$正确;
$\rm B$. 据分析,铅锌矿$\rm ($主要成分为$\text{PbS}\mathrm{}\text{ZnS}\rm )$富氧煅烧得到$\rm SO_{2}$和$\rm Pb$、$\rm Zn$元素的氧化物,则产物$\rm B$主要是铅氧化物与锌氧化物,$\rm B$正确;
$\rm C$. 据分析,化合物$\rm C$是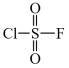 ,卤素原子被$\rm -OH$取代后生成$\rm H_{2}SO_{4}$和$\rm HCl$、$\rm HF$,则$\text{1\;\rm mol}$化合物$\rm C$在水溶液中最多可中和$4\;\rm mol\;\rm NaOH$,$\rm C$错误;
,卤素原子被$\rm -OH$取代后生成$\rm H_{2}SO_{4}$和$\rm HCl$、$\rm HF$,则$\text{1\;\rm mol}$化合物$\rm C$在水溶液中最多可中和$4\;\rm mol\;\rm NaOH$,$\rm C$错误;
$\rm D$. $\text{ClF}$的氧化性由$\rm +1$价的$\rm Cl$表现,$\rm Cl_{2}$的氧化性由$\rm 0$价的$\rm Cl$表现,则$\rm ClF$的氧化锌强于$\text{C}{{\text{l}}_{2}}$,$\rm D$错误;
故选:$\rm AB$。
$\rm D$的结构为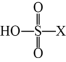 ($\text{X=F}$或$\text{Cl}$),设计实验先除去样品$\rm D$中的硫元素,再用除去硫元素后的溶液探究$\rm X$为何种元素。
($\text{X=F}$或$\text{Cl}$),设计实验先除去样品$\rm D$中的硫元素,再用除去硫元素后的溶液探究$\rm X$为何种元素。
①实验方案:取$\rm D$的溶液,加入足量$\text{NaOH}$溶液,加热充分反应,然后 ;
②写出$\rm D$(用$\text{HS}{{\text{O}}_{3}}\text{X}$表示)的溶液与足量$\text{NaOH}$溶液反应的离子方程式 。
加入足量$\\rm Ba(NO_{3})_{2}$溶液充分反应,静置后取上层清液,再加入硝酸酸化的$\\rm AgNO_{3}$溶液,若产生白色沉淀,则有$\\rm Cl^{-}$,反之则有$\\rm F^{-}$; $\\text{HS}{{\\text{O}}_{3}}\\text{X}\\rm +3OH^{-}=\\text{SO}_{4}^{2-}\\rm +X^{-}+2H_{2}O$
"]]①$\rm D$的结构为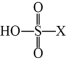 $\rm (X=F$或$\rm Cl)$,加入足量$\rm NaOH$溶液,加热充分反应,生成$\rm Na_{2}SO_{4}$和$\rm NaX$,则实验方案为:取$\rm D$的溶液,加入足量$\rm NaOH$溶液,加热充分反应,然后加入足量$\rm Ba(NO_{3})_{2}$溶液充分反应,静置后取上层清液,再加入硝酸酸化的$\rm AgNO_{3}$溶液,若产生白色沉淀,则有$\rm Cl^{-}$,反之则有$\rm F^{-}$;②$\rm D($用$\rm HSO_{3}X$表示$\rm )$的溶液与足量$\rm NaOH$溶液反应生成$\rm Na_{2}SO_{4}$和$\rm NaX$,发生反应的离子方程式是:$\rm HSO_{3}X+3OH^{-}=SO_{4}^{2-}\rm +X^{-}+2H_{2}O$。
$\rm (X=F$或$\rm Cl)$,加入足量$\rm NaOH$溶液,加热充分反应,生成$\rm Na_{2}SO_{4}$和$\rm NaX$,则实验方案为:取$\rm D$的溶液,加入足量$\rm NaOH$溶液,加热充分反应,然后加入足量$\rm Ba(NO_{3})_{2}$溶液充分反应,静置后取上层清液,再加入硝酸酸化的$\rm AgNO_{3}$溶液,若产生白色沉淀,则有$\rm Cl^{-}$,反之则有$\rm F^{-}$;②$\rm D($用$\rm HSO_{3}X$表示$\rm )$的溶液与足量$\rm NaOH$溶液反应生成$\rm Na_{2}SO_{4}$和$\rm NaX$,发生反应的离子方程式是:$\rm HSO_{3}X+3OH^{-}=SO_{4}^{2-}\rm +X^{-}+2H_{2}O$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
