高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙$\rm (CaO_{2}\rm )$。大理石的主要杂质是$\rm Fe_{2}O_{3}$,以下是提纯大理石的实验步骤:
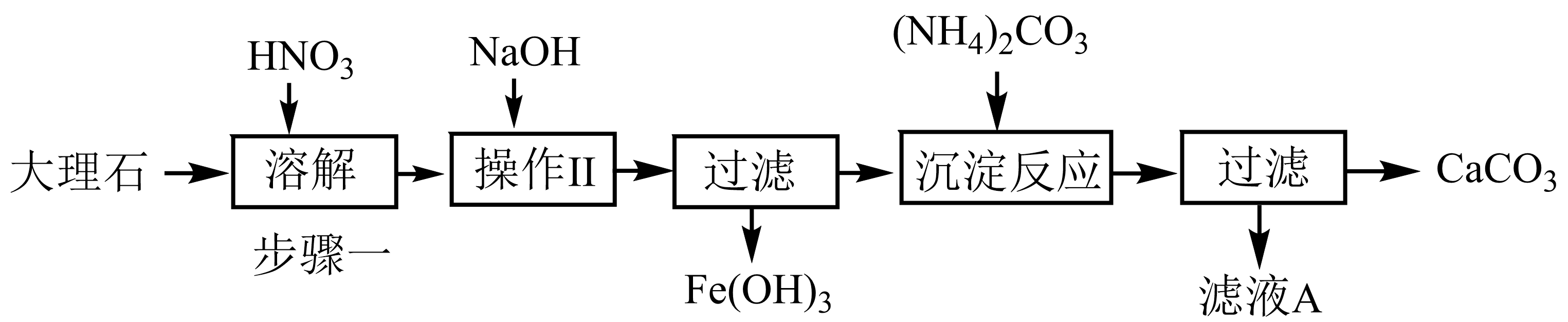
为加快步骤一中的固体溶解,可采取的措施有 $\rm ($只写一点$\rm )$。
粉碎大理石等
"]]加快固体溶解可以用粉碎大理石,或者搅拌等措施;
溶解大理石时,用硝酸而不用硫酸的原因是 。
$\\rm H_{2}SO_{4}$会形成微溶的$\\rm CaSO_{4}$,阻碍反应的继续进行,$\\rm HNO_{3}$能保证反应持续进行
"]]硫酸与碳酸钙反应生成硫酸钙,硫酸钙微溶于水,阻碍反应的继续进行,$\rm HNO_{3}$能保证反应持续进行;
过滤时,不需要用到的玻璃仪器有$\rm (\quad\ \ \ \ )$。
漏斗
","分液漏斗
","玻璃棒
","烧杯
"]过滤需要用到的玻璃仪器是烧杯、漏斗、玻璃棒,不需要分液漏斗;
操作Ⅱ的目的是 。
生成$\\rm Fe(OH)_{3}$沉淀,除去杂质
"]]操作$\rm II$使铁离子形成$\rm Fe(OH)_{3}$沉淀除去;
检验$\rm Fe^{3+}$已完全转化为$\rm Fe(OH)_{3}$沉淀的方法是 。
取上层清液,滴加$\\rm KSCN$溶液,若溶液出现血红色,证明没有沉淀完全,若溶液没有变化,证明已沉淀完全
"]]$\rm Fe^{3+}$完全转化为$\rm Fe(OH)_{3}$沉淀,说明溶液中没有$\rm Fe^{3+}$,检验$\rm Fe^{3+}$方法是:取上层清液,滴加$\rm KSCN$溶液,若溶液出现血红色,证明没有沉淀完全,若溶液没有变化,证明已沉淀完全;
写出沉淀反应中生成$\rm CaCO_{3}$的离子方程式 。
$\\rm Ca^{2+} + CO_{3}^{2−} = CaCO_{3}↓$
"]]加入碳酸铵使钙离子沉淀,反应的离子方程式为:$\rm Ca^{2+} + CO_{3}^{2−} = CaCO_{3}↓$;
检验滤液$\rm A$中$\rm NH_{4}^{+}$不需要用到的试剂及操作是$\rm (\quad\ \ \ \ )$。
$\\rm NaOH$溶液
","加热
","稀硫酸
","红色石蕊试纸
"]检验$\rm NH_{4}^{+}$离子的方法是加入$\rm NaOH$溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明有铵根离子,不需要用到稀硫酸;
已知过氧化钙和过氧化钠的化学性质相似,下列说法正确的是$\rm (\quad\ \ \ \ )$。
过氧化钙是碱性氧化物
","能与水反应,因此过氧化钙可用于气体的干燥
","与水反应时,过氧化钙作氧化剂,水作还原剂
","与二氧化碳反应时,过氧化钙既作氧化剂又作还原剂
"]$\rm A\rm .$ 过氧化钙是过氧化物,不是碱性氧化物,$\rm A$错误;
$\rm B\rm .$ 能与水反应生成$\rm O_{2}$,又引入了气体杂质,因此过氧化钙不可用于气体的干燥,$\rm B$错误;
$\rm C\rm .$ 与水反应时,过氧化钙既作氧化剂又做还原剂,$\rm C$错误;
$\rm D\rm .$ 与二氧化碳反应时,过氧化钙既作氧化剂又作还原剂,$\rm D$正确;
答案选$\rm D$。
除了过氧化钙可以杀菌消毒,生活中还有很多物质也常用于杀菌消毒。请举出一种常见的消毒剂 。
$\\rm 84$消毒液$\\rm ($或$\\rm NaClO)$、双氧水等
"]]生活中还有$\rm 84$消毒液、双氧水等也常用于杀菌消毒。
高中 | 离子方程式题目答案及解析(完整版)
