高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
北京奥运会“祥云”火炬燃料是丙烷$\rm (C_{3}H_{8}\rm )$,亚特兰大奥运会火炬燃料是丙烯$\rm (C_{3}H_{6}\rm )$。
已知:$\rm C_{3}H_{8}(g) = CH_{4}(g) + C_{2}H_{2}(g) + H_{2}(g)$ $\rm \Delta H_{1} = +156.6\;\rm kJ ⋅ mol^{-1}$
$\rm C_{3}H_{6}(g) = CH_{4}(g) + C_{2}H_{2}(g)$ $\rm \Delta H_{2} = +32.4\;\rm kJ ⋅ mol^{-1}$
丙烷分子中极性键和非极性键数目的比值为 。
$\\rm 4:1$
"]]通常,不同非金属元素之间形成的共价键是极性共价键,而同种非金属元素之间形成的共价键为非极性共价键,故每一个丙烷分子中极性键即$\rm C-H$键有$\rm 8$个,非极性键即$\rm C-C$键有$\rm 2$个,二者数目的比值为$\rm 8:2=4:1$;
上述两个反应能在 $\rm ($填“高温”、“低温”或“任何”$\rm )$条件下自发进行。
高温
"]]由题干信息可知,上述两个反应均为气体体积增大即熵增的吸热即焓增反应,根据吉布斯自由能变$\rm (\Delta H − T\Delta S\lt 0)$可判断,两个反应能在高温条件下自发进行;
相同条件下,反应$\rm C_{3}H_{8}(g) = C_{3}H_{6}(g) + H_{2}(g)$的$\rm \Delta H=$ $\rm \;\rm kJ ⋅ mol^{-1}$
$\\rm +124.2$
"]]已知反应$\rm I$:$\rm C_{3}H_{8}(g) = CH_{4}(g) + C_{2}H_{2}(g) + H_{2}(g)$ $\rm \Delta H_{1} = +156.6\;\rm kJ ⋅ mol^{-1}$,反应$\rm II$:$\rm C_{3}H_{6}(g) = CH_{4}(g) + C_{2}H_{2}(g)$ $\rm \Delta H_{2} = +32.4\;\rm kJ ⋅ mol^{-1}$,则反应可由反应$\rm I-$反应$\rm II$而得,故$\rm \Delta H = \Delta H_{1} − \Delta H_{2}\rm =(+156.6\;\rm kJ/mol)-(+32.4\;\rm kJ/mol)=+124.2$ $\rm kJ/mol$;
如图以丙烷为燃料制作新型燃料电池,电解质是熔融碳酸盐。
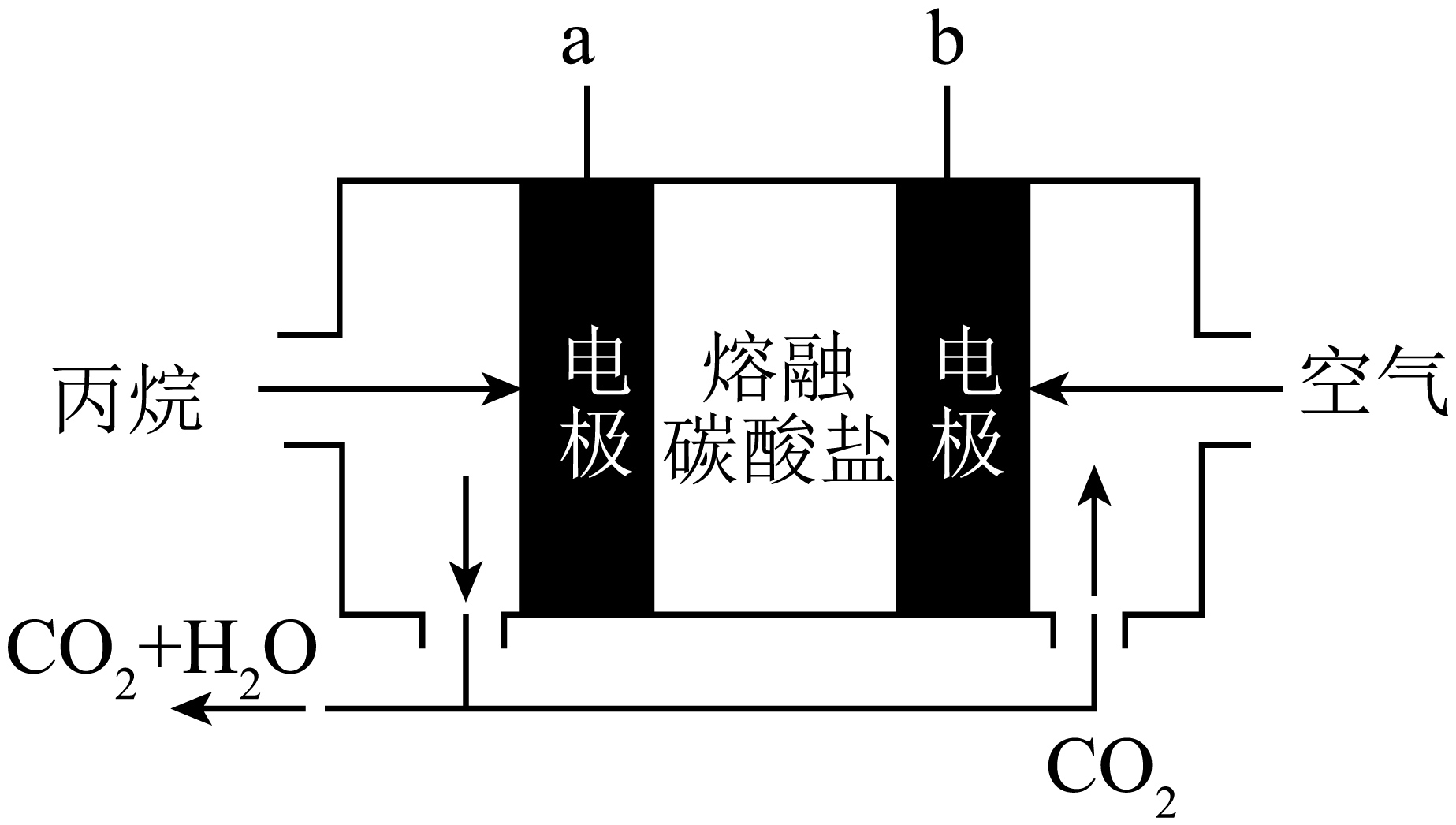
①$\rm b$极为 $\rm ($填“正”或“负”$\rm )$极,$\rm b$极的电极反应式为 。
②以上述电池为电源给铁制器件镀铜,当 极$\rm ($填“阴”或“阳”$\rm )$质量增加$\rm 6.4\;\rm g$时,消耗标况下的丙烷 $\rm \;\rm L$。
正 $\\rm O_{2}+4e^{−}+2CO_{2}=2CO_{3}^{2−}$ 阴 $\\rm 0.224$
"]]①如图在丙烷为燃料制作新型燃料电池,电解质是熔融碳酸盐,通入丙烷一极发生氧化反应,为负极,故$\rm a$为负极,电极反应式为$\rm C_{3}H_{8} − 20e^{−}+10CO_{3}^{2−}=4H_{2}O+13CO_{2}$,通入空气一极为正极,故$\rm b$为正极,电极反应式为$\rm O_{2}+4e^{−}+2CO_{2}=2CO_{3}^{2−}$;②以上述电池为电源给铁制器件镀铜,阴极发生的反应为$\rm Cu^{2+}+2e^{−}=Cu$,当阴质量增加$\rm 6.4\;\rm g$时,电路中转移的电子的物质的量为$\rm \dfrac{6.4\text{g}}{64\text{g}/\text{mol}} \times 2 = 0.2\;\rm \text{mol}$,电池的负极反应为$\rm C_{3}H_{8} − 20e^{−}+10CO_{3}^{2−}=4H_{2}O+13CO_{2}$,所以消耗$\rm 0.01\;\rm mol$丙烷,标准状况下的体积为$\rm 0.01\;\rm mol \times 22.4\;\rm L/mol=0.224\;\rm L$。
高中 | 盖斯定律题目答案及解析(完整版)
