高中 | 金属矿物的开发及利用 题目答案及解析
稿件来源:高途
高中 | 金属矿物的开发及利用题目答案及解析如下,仅供参考!
必修二
第四章 化学与可持续发展
第一节 开发利用金属矿物和海水资源
金属矿物的开发及利用
埃林汉姆图,由英国物理化学家哈罗德$\rm ·$埃林汉姆于$\rm 1944$年最先制作,在冶金工业中可用于评估氧化物的热稳定性。图像中,每条直线代表该反应吉布斯自由能($\rm \Delta H − T\Delta S$)与温度的关系。
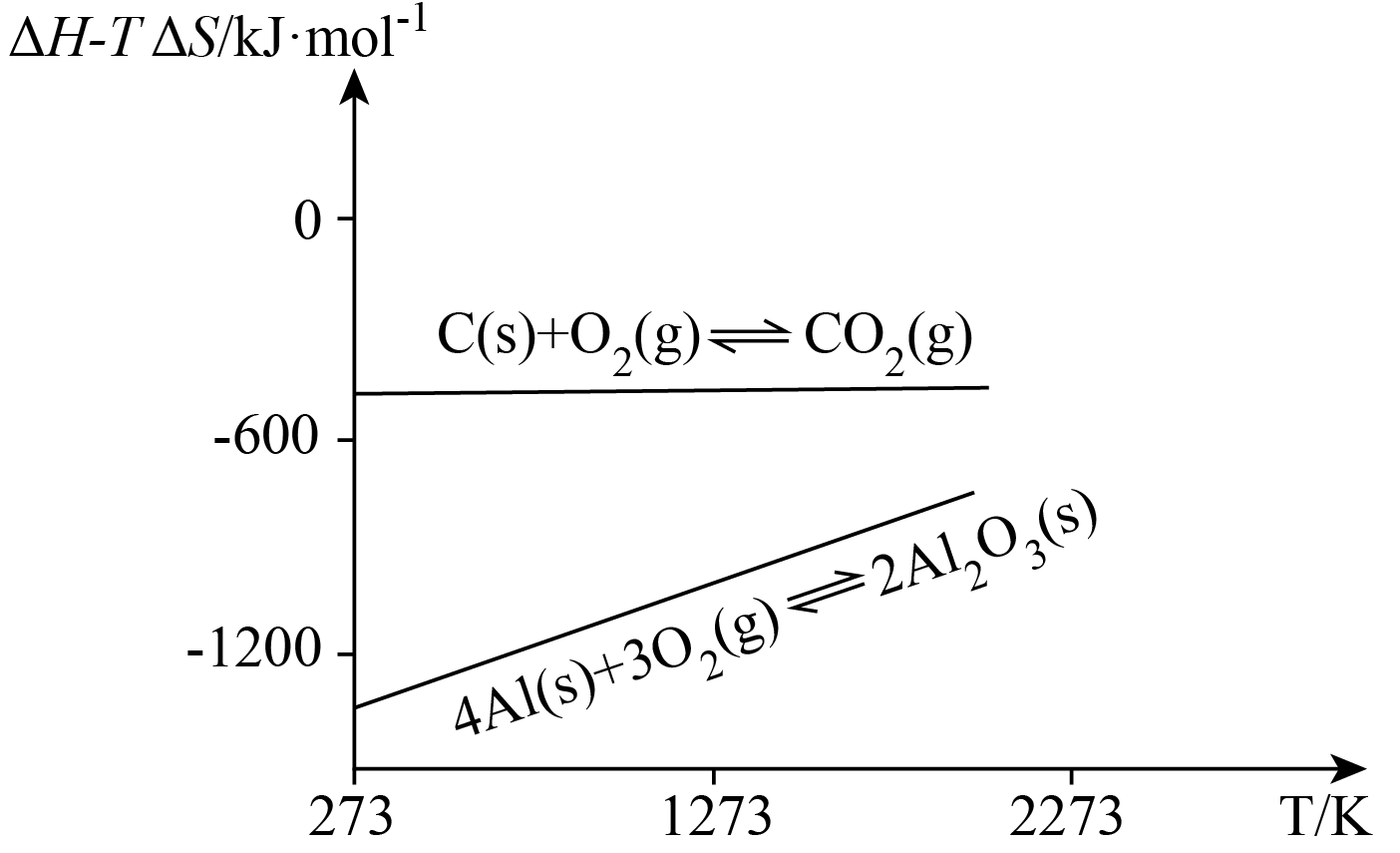
反应$\rm C(s) + O_{2}(g) ⇌ CO_{2}(g)$在埃林汉姆图中的斜率近似为$\rm 0$,请简述原因 。
埃林汉姆图中的直线斜率代表反应的$\\rm \\Delta S$,而该反应前后气体分子数相同,即反应的$\\rm \\Delta S$几乎为$\\rm 0$,故斜率近似为$\\rm 0$
"]]反应$\rm C(s) + O_{2}(g) ⇌ CO_{2}(g)$在埃林汉姆图中的斜率近似为$\rm 0$,原因为埃林汉姆图中的直线斜率代表反应的$\rm \Delta S$,而该反应前后气体分子数相同,即反应的$\rm \Delta S$几乎为$\rm 0$,故斜率近似为$\rm 0$。
结合图像推测,若以$\rm Al_{2}O_{3}$为原料,理论上$\rm (\quad\ \ \ \ )$用热分解法获得铝单质。
可以
","不可以
"]结合图像,铝和氧气的反应在一定温度下可以自发进行,理论上,$\rm Al_{2}O_{3}$分解制取铝也可以在一定温度下自发进行,则理论上可以用热分解法获得铝单质,故选:$\rm A$。
工业中,以$\rm Al_{2}O_{3}$为原料,采用电解法冶炼金属铝,在$\rm (\quad\ \ \ \ )$极获得铝单质。
正
","负
","阳
","阴
"]工业中,以$\rm Al_{2}O_{3}$为原料,采用电解法冶炼金属铝,其中铝离子得到电子生成$\rm Al$,故在阴极获得铝单质,故选:$\rm D$。
写出阳极的电极方程式 。
$\\rm 2O^{2−} − 4e^{−} = O_{2}$
"]]以$\rm Al_{2}O_{3}$为原料,采用电解法冶炼金属铝,阳极上氧离子失去电子生成氧气,电极方程式$\rm 2O^{2−} − 4e^{−} = O_{2}$。
若电解一段时间后,收集到标况下$\rm 56\;\rm L$气体,则这段时间内电路中转移的电子数目为 个。
$\\rm 10N_{A}$
"]]若电解一段时间后,收集到标况下$\rm 56\;\rm L$气体,可知该气体为氧气,其物质的量为$\rm \dfrac{\text{56\;\rm L}}{\text{22.4/mol}} = 2.5\;\rm \text{mol}$,根据$\rm 2O^{2−} − 4e^{−} = O_{2}$,则这段时间内电路中转移的电子数目为$\rm 2.5\;\rm mol \times 4 \times N_{A}/mol=10N_{A}$个。
写出以$\rm HgO$为原料,冶炼金属$\rm Hg$的化学方程式 。
$\\rm \\text{2HgO}\\begin{array}{r} \\underline{\\underline{\\Delta}} \\\\ \\end{array}\\text{2Hg} + \\text{O}_{2} \\uparrow$
"]]以$\rm HgO$为原料,可以通过热分解法冶炼金属$\rm Hg$,化学方程式$\rm \text{2HgO}\begin{array}{r} \underline{\underline{\Delta}} \\ \end{array}\text{2Hg} + \text{O}_{2} \uparrow$。
高中 | 金属矿物的开发及利用题目答案及解析(完整版)
