| 铁的氧化物 题目答案及解析
稿件来源:高途
| 铁的氧化物题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁的氧化物
元素周期表的意义远远超出了化学领域本身,它体现了科学规律的本质。如图是元素周期表的一部分,表中所列字数编号分别代表对应的化学元素。
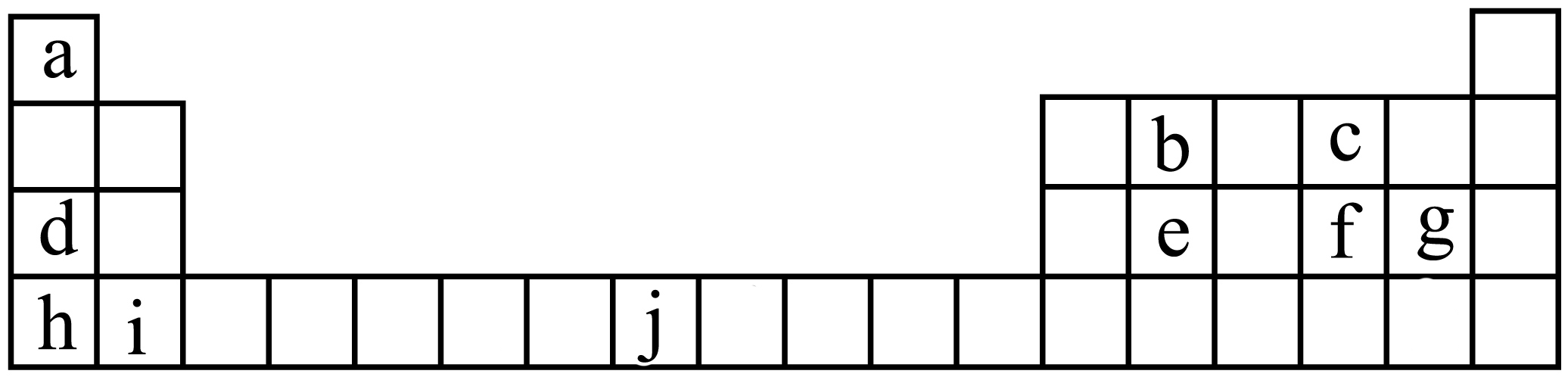
图中所示元素形成的物质中,最高价氧化物对应水化物酸性最强的是 $\rm ($填化学式$\rm )$,可用作半导体材料的是 $\rm ($填元素符号$\rm )$,属于过渡元素的是 $\rm ($填元素符号$\rm )$。
$\\rm HClO_{4}$; $\\rm Si$ ;$\\rm Fe$
"]]①根据同周期元素,从左到右非金属性逐渐增强,同主族元素从上到下非金属性逐渐减弱,图中所示元素形成的物质中,最高价氧化物对应水化物酸性最强的是$\rm HClO_{4}$,故答案为:$\rm HClO_{4}$;
②$\rm Si$的导电性介于导体和非导体之间,可用作半导体材料,故答案为:$\rm Si$;
③副族和第Ⅷ族元素属于过渡元素,属于过渡元素的是$\rm Fe$,故答案为:$\rm Fe$;
$b$元素可形成各类丰富的化合物,它在周期表中的第 周期第 族,其氧化物的随意排放可能导致的环境问题是 。
二 ;Ⅳ$\\rm A$ ;温室效应
"]]①$b$为$\rm C$,可形成各类丰富的化合物,它在周期表中的第二周期第Ⅳ$\rm A$族,故答案为:二;
②由①可知,碳在周期表中的第二周期第Ⅳ$\rm A$族,故答案为:Ⅳ$\rm A$;
③碳的氧化物$\rm CO_{2}$随意排放可能导致的环境问题是温室效应,故答案为:温室效应;
$\rm j$元素的氧化物有着不同的颜色和性质:甘肃省张掖七彩丹霞地貌的岩层呈红色是因为有 $\rm ($填化学式$\rm )$。
$\\rm Fe_{2}O_{3}$
"]]$\rm j$为$\rm Fe$,$\rm Fe$元素的氧化物有着不同的颜色和性质,甘肃省张掖七彩丹霞地貌的岩层呈红色是因为$\rm Fe_{2}O_{3}$,故答案为:$\rm Fe_{2}O_{3}$;
$c$、$\rm e$、$\rm f$元素的简单气态氢化物的稳定性由强到弱的顺序为 $\rm ($填化学式$\rm )$。
$\\rm H_{2}O\\gt H_{2}S\\gt H_{4}Si$
"]]$c$为$\rm O$,$\rm e$为$\rm Si$,$\rm f$为$\rm S$,$c$、$\rm e$、$\rm f$元素的简单气态氢化物为$\rm H_{2}O$、$\rm H_{2}S$、$\rm H_{4}Si$,非金属性越强,氢化物越稳定,非金属性:$\rm O\gt S\gt Si$,故氢化物稳定性:$\rm H_{2}O\gt H_{2}S\gt H_{4}Si$,故答案为:$\rm H_{2}O\gt H_{2}S\gt H_{4}Si$;
$\rm d$、$\rm h$元素中,金属性更强的是 $\rm ($填元素符号$\rm )$,请从原子结构角度解释其原因: 。
$\\rm K$ ;$\\rm Na$、$\\rm K$为同主族元素,随原子序数递增,原子半径增大,失电子能力增强,金属性增强
"]]①$\rm d$为$\rm Na$,$\rm h$为$\rm K$,金属性更强的是$\rm K$,故答案为:$\rm K$;
②金属性更强的是$\rm K$,是因为$\rm Na$、$\rm K$为同主族元素,随原子序数递增,原子半径增大,失电子能力增强,金属性增强,故答案为:$\rm Na$、$\rm K$为同主族元素,随原子序数递增,原子半径增大,失电子能力增强,金属性增强;
$\rm d$元素的过氧化物常用于潜艇供氧剂,根据相应元素的结构推测该化合物含有的化学键类型有 $\rm ($填“离子键”、“共价键”、“金属键”$\rm )$。
离子键、共价键
"]]$\rm d$元素的过氧化物常用于潜艇供氧剂为$\rm Na_{2}O_{2}$,过氧化钠中含有离子键、共价键,故答案为:离子键、共价键;
下列说法正确的是$(\quad\ \ \ \ )$。
可以通过$\\rm Na$和$\\text{MgC}{{\\text{l}}_{2}}$溶液的置换反应来说明$\\rm Na$和$\\rm Mg$的金属性强弱
","离子半径:${{\\text{S}}^{2-}}\\gt \\text{C}{{\\text{l}}^{-}}\\gt \\text{N}{{\\text{a}}^{+}}\\gt \\text{A}{{\\text{l}}^{3+}}$
","氧化性:$\\text{S}\\gt {\\rm C}{{\\text{l}}_{2}}$
","$\\rm F$、$\\rm N$、$\\rm C$最高正价依次递减
"]$\rm A$.$\rm Na$与水反应生成氢氧化钠,不能置换氯化镁中的镁,故$\rm A$项错误;
$\rm B$.粒子半径电子层数越多,离子半径越大;电子层结构相同时,核电荷数越大,粒子半径越小,故离子半径:$\rm S^{2-}\gt Cl^{-}\gt Na^{+}\gt Al^{3+}$,故$\rm B$项正确;
$\rm C$.非金属性越强,氧化性越强,硫、氯在同一周期,从左到右非金属性依次增强,故氧化性:$\rm S\lt Cl_{2}$,故$\rm C$项错误;
$\rm D$.$\rm F$没有正价、$\rm N$、$\rm C$最高正价依次递减,故$\rm D$项错误;
故答案为:$\rm B$。
| 铁的氧化物题目答案及解析(完整版)
