高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
高纯硫酸锰主要应用于三元锂电池正极材料的合成,一种使用高硫锰矿和软锰矿$\rm ($主要成分为$\rm MnO_{2}\rm )$制备硫酸锰的工艺如图:
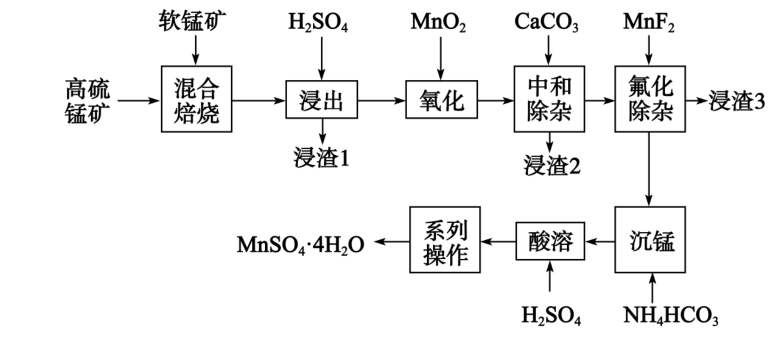
已知:混合焙烧后得到的烧渣主要为$\rm MnSO_{4}、Fe_{2}O_{3}、FeO、Al_{2}O_{3}、MgO、CaO、SiO_{2}$;离子浓度$\rm ≤ 10^{-5}\;\rm mol ⋅ L^{-1}$,可认为离子沉淀完全。
原料高硫锰矿与软锰矿按一定比例焙烧,焙烧前需要将二者粉碎的原因是 。
增大反应物接触面积,加快反应速率,使反应更彻底
"]]焙烧前需要球磨,目的是增大接触面积,提高焙烧效率;
加入硫酸浸出后获得的浸渣$\rm 1$主要成分为 。
$\\rm SiO_{2}$、$\\rm CaSO_{4}$
"]]由分析,浸渣$\rm 1$主要成分为$\rm SiO_{2}$、$\rm CaSO_{4}$;
氧化时发生反应的离子方程式为 。
$\\rm MnO_{2}+4H^{+}+2Fe^{2+} = Mn^{2+}+2Fe^{3+}+2H_{2}O$
"]]氧化时发生反应二氧化锰将氧化亚铁离子为铁离子,离子方程式为$\rm MnO_{2}+4H^{+}+2Fe^{2+} = Mn^{2+}+2Fe^{3+}+2H_{2}O$;
氟化除杂是除去$\rm Ca^{2+}$和$\rm Mg^{2+}$的重要方法,某$\rm 1 L$溶液中$\rm Ca^{2+}$和$\rm Mg^{2+}$的浓度分别为$\rm 0.02 mol ⋅ L^{-1}$、$\rm 0.01 mol ⋅ L^{-1}$,若使溶液中的$\rm Ca^{2+}$和$\rm Mg^{2+}$沉淀完全,加入的$\rm MnF_{2}$的质量至少是 $\rm \;\rm g\rm ($保留小数点后$\rm 1$位$\rm )$;若溶液的$\rm H^{+}$浓度过大,将导致$\rm Ca^{2+}$、$\rm Mg^{2+}$沉淀不完全,原因是 。$\rm ($已知$\rm K_{sp}(MgF_{2})=9 \times 10^{-9}$、$\rm K_{sp}(CaF_{2})=1.5 \times 10^{-10}\rm )$
$\\rm 4.2$ $\\rm H^{+}$与$\\rm F^{-}$结合形成弱电解质$\\rm HF$,使$\\rm CaF_{2}$、$\\rm MgF_{2}$的溶解平衡右移或$\\rm H^{+}$与$\\rm F^{-}$结合形成弱电解质$\\rm HF$,$\\rm F^{-}$浓度小,很难将$\\rm Ca^{2+}$、$\\rm Mg^{2+}$沉淀完全
"]]由$\rm K$值可知,氟化镁溶解度较氟化钙大,镁离子完全沉淀,则$\rm \text{c}\left( \text{F}^{-} \right)=\sqrt{\dfrac{\text{K}_{\text{sp}}\left( \text{MgF}_{\text{2}} \right)}{\text{c}\left( \text{Mg}^{\text{2+}} \right)}}=\sqrt{\dfrac{\text{9} \times \text{10}^{\text{-9}}}{\text{10}^{- 5}}}{mol/L=0.03\;\rm mol/L}$,则加入的$\rm MnF_{2}$至少为$\rm (0.02+0.01+0.03\div 2)mol/L\times 1\;\rm L=0.045\;\rm mol$,质量至少是$\rm 4.2\;\rm g$;$\rm H^{+}$与$\rm F^{-}$结合形成弱电解质$\rm HF$,使$\rm CaF_{2}$、$\rm MgF_{2}$的溶解平衡右移或$\rm H^{+}$与$\rm F^{-}$结合形成弱电解质$\rm HF$,$\rm F^{-}$浓度小,很难将$\rm Ca^{2+}$、$\rm Mg^{2+}$沉淀完全,导致溶液的$\rm H^{+}$浓度过大,使得$\rm Ca^{2+}$、$\rm Mg^{2+}$沉淀不完全;
沉锰时发生反应的离子方程式为 。
$\\rm Mn^{2+}+2HCO_{3}^{−} = MnCO_{3} ↓ +H_{2}O+CO_{2}↑$
"]]含锰离子溶液加入碳酸氢铵得到$\rm MnCO_{3}$沉淀,反应为锰离子和碳酸氢根离子生成碳酸锰、水、二氧化碳:$\rm Mn^{2+}+2HCO_{3}^{−} = MnCO_{3} ↓ +H_{2}O+CO_{2}↑$;
一种在硫酸溶液中电解锂离子电池正极材料$\rm LiMn_{2}O_{4}$获得$\rm MnO_{2}$的装置如图,则阴极电极反应式为 。
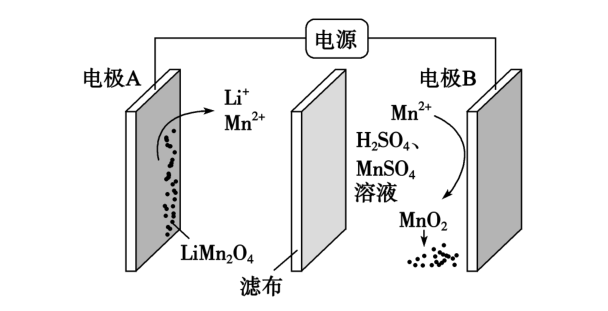
$\\rm LiMn_{2}O_{4}+8H^{+}+3e^{-} = Li^{+}+4H_{2}O+2Mn^{2+}$
"]]由图,阴极$\rm LiMn_{2}O_{4}$在酸性条件下得到电子发生还原反应生成锰离子、锂离子和水:$\rm LiMn_{2}O_{4}+8H^{+}+3e^{-} = Li^{+}+4H_{2}O+2Mn^{2+}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
