| 氯气 题目答案及解析
稿件来源:高途
| 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
从海水中可以提取溴、镁等物质,流程如下:
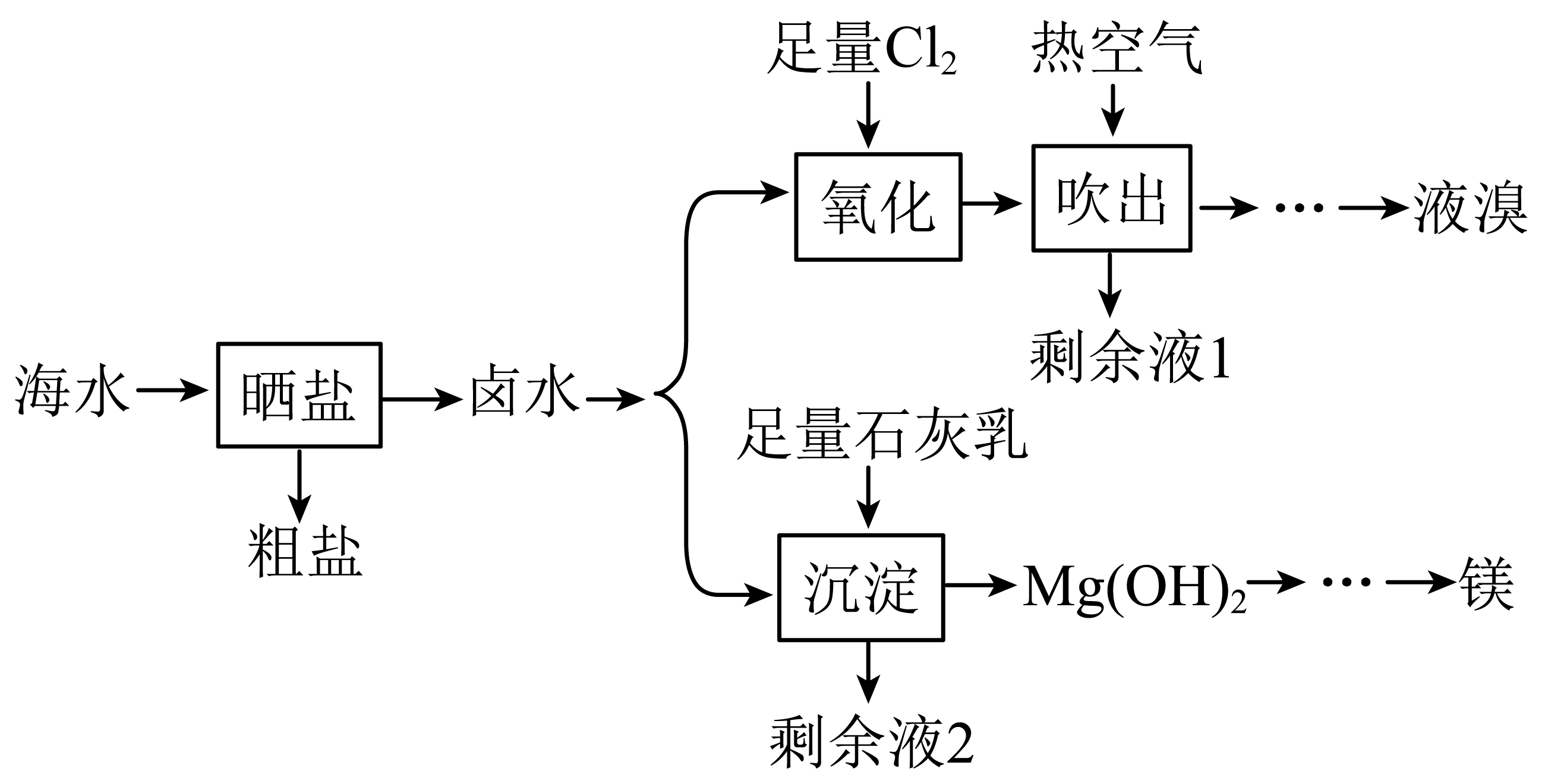
采用晒盐后的卤水为原料进行提溴而不是直接使用海水,原因是 。
海水中的$\\text{B}{{\\text{r}}^{-}}$浓度低,直接提取效率低
"]]海水中的$\text{B}{{\text{r}}^{-}}$浓度低,直接提取效率低,因此一般采用晒盐后的卤水为原料进行提溴。
提溴“氧化”环节发生反应的离子方程式为 。
$2\\text{B}{{\\text{r}}^{-}}+\\text{C}{{\\text{l}}_{2}}=2\\text{C}{{\\text{l}}^{-}}+\\text{B}{{\\text{r}}_{2}}$
"]]提溴“氧化”环节氯气将溴离子氧化为溴单质,反应离子方程式为:$2\text{B}{{\text{r}}^{-}}+\text{C}{{\text{l}}_{2}}=2\text{C}{{\text{l}}^{-}}+\text{B}{{\text{r}}_{2}}$。
通入热空气进行溴的吹出,符合不同温度下空气通入量与溴吹出率关系的图示是 。
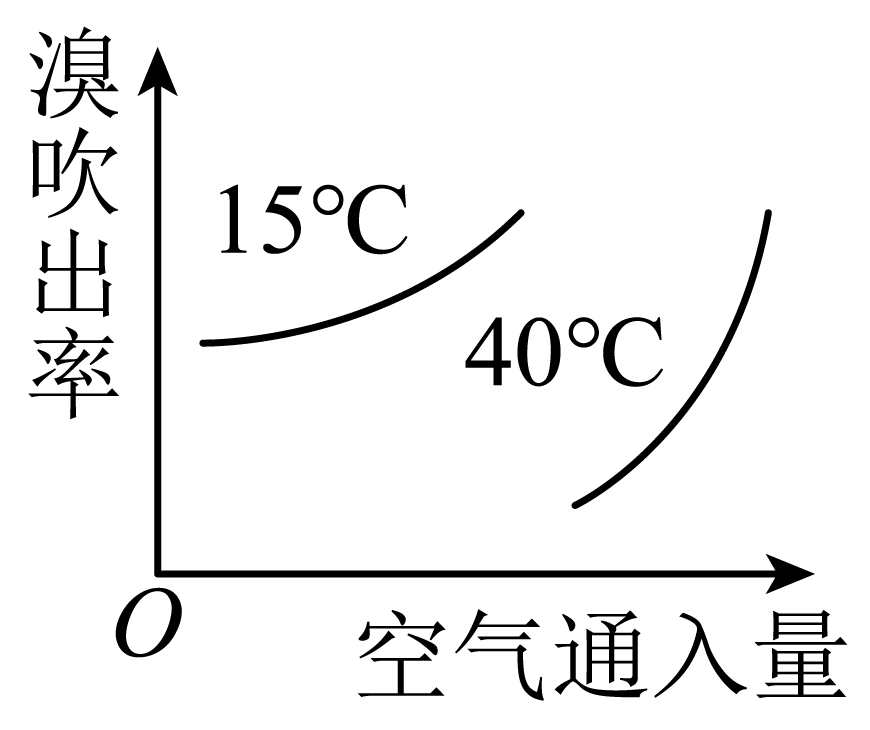 | 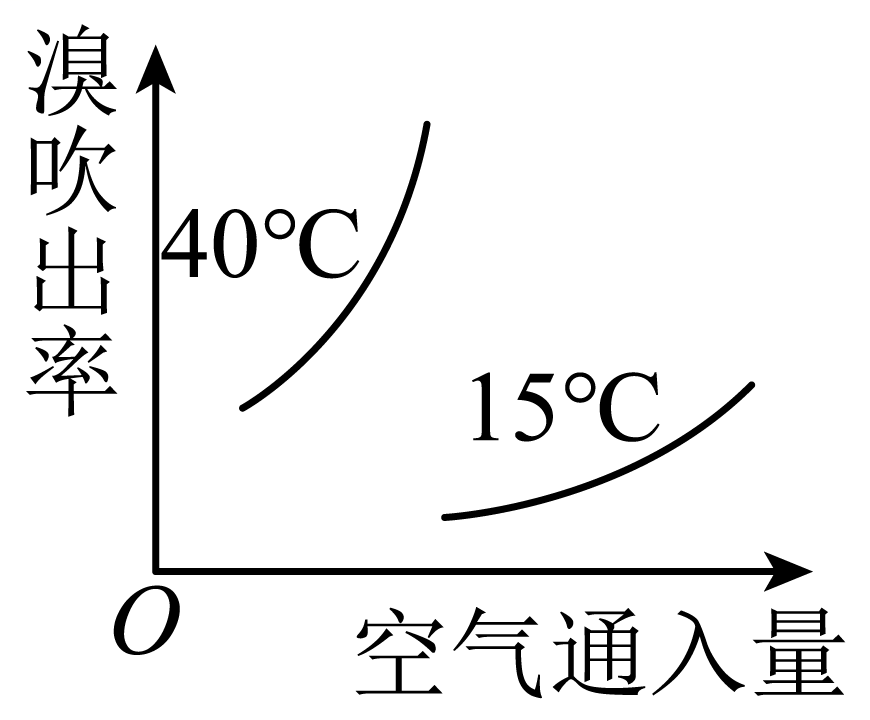 | 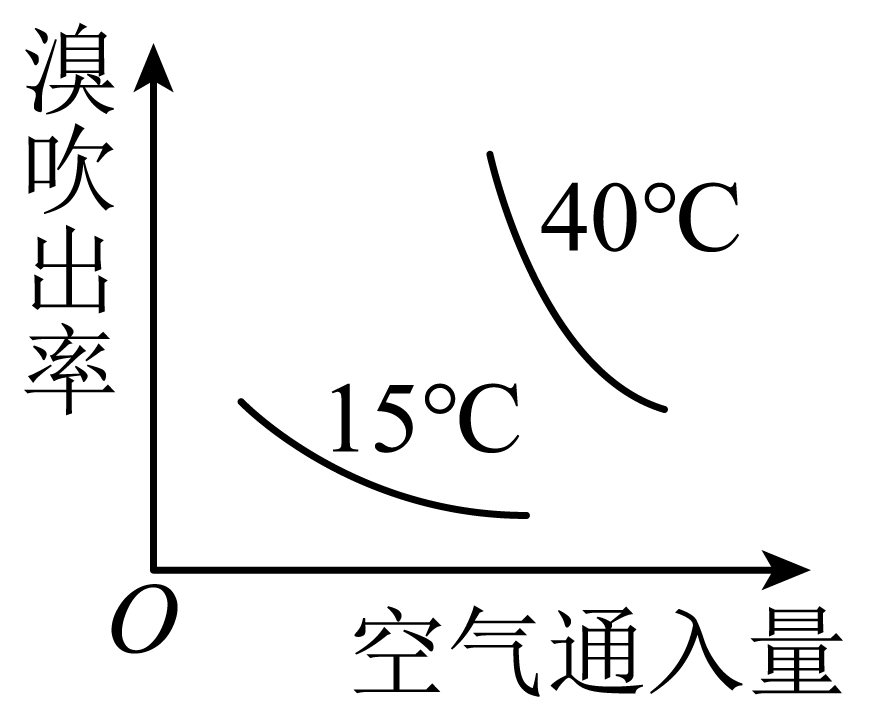 |  |
| $\rm A$ | $\rm B$ | $\rm C$ | $\rm D$ |
$\\rm B$
"]]空气通入量相同时,温度越高,溴的吹出率越高;在相同温度条件下,空气的通入量越多,溴的吹出率越高,因此符合的图像为$\rm B$。
$1\;{{\text{m}}^{3}}$海水经上述流程最终得到$\rm 38.4\;{g\;B}{{\text{r}}_{2}}$,若总提取率为$\rm 60\%$,原海水中溴离子的浓度是 $\text{mmol}\cdot {{\text{L}}^{-1}}$。
$\\rm 0.8$
"]]$\rm 1\;{{ {m}}^{3}}$海水经上述流程最终得到$\rm 38.4 \;{g\;B}{{ {r}}_{2}}$,所得溴单质的物质的量为$\rm \dfrac{ {38} {.4\;\rm g}}{ {160\;\rm g/mol}}=0.24\;\rm {mol}$,溴原子的物质的量为$\rm 0.48\;\rm mol$,总提取率为$\rm 60\%$,则原海水中的溴离子为$\rm \dfrac{ {0} {.48\;\rm mol}}{ {60 } \% }=0.8\;\rm {mol}$,原海水中溴离子的浓度是$\rm \dfrac{ {0} {.8}\times {1000\;\rm mm ol}}{ {1000\;\rm L}}= {0} {.8\;\rm mm ol}\cdot {{ {L}}^{-1}}$。
从充分利用海洋化学资源,提高经济效益的角度考虑,提镁“沉淀”过程所需石灰乳的原料主要来源于海洋中的$(\quad\ \ \ \ )$。
珊瑚礁
","贝壳
","海底石灰岩
","海带
"]提镁“沉淀”过程所需石灰乳的原料主要来源于海洋中的贝壳。
关于卤水提取的先后顺序,两位工程师有不同观点:
甲:先用卤水提溴,剩余液$\rm 1$用于提镁;
乙:先用卤水提镁,剩余液$\rm 2$用于提溴。
判断哪种方案更佳?并简述理由 。
甲方案更佳,若先提取镁,卤水中会残留较多$\\text{Ca}{{(\\text{OH})}_{2}}$,再用$\\text{C}{{\\text{l}}_{2}}$提取溴时会消耗更多$\\text{C}{{\\text{l}}_{2}}$
"]]甲方案更佳,若先提取镁,卤水中再加入过量石灰乳后,卤水中会残留较多$\text{Ca}{{(\text{OH})}_{2}}$,再用$\text{C}{{\text{l}}_{2}}$提取溴时会消耗更多$\text{C}{{\text{l}}_{2}}$。
| 氯气题目答案及解析(完整版)
