高中 | 氮气的结构、性质和用途 题目答案及解析
稿件来源:高途
高中 | 氮气的结构、性质和用途题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第四节 氨 硝酸 硫酸
氮气的结构、性质和用途
氮氧化物$ (\text{N}{{\text{O}}_{x}}\rm )$的任意排放会造成酸雨、光化学烟雾等环境污染问题,有效处理氮氧化物目前已经成为重要的研究课题。
请用化学方程式解释汽车尾气中$\rm NO$产生的主要原因: 。
${{\\text{N}}_{2}}+{{\\text{O}}_{2}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\\\end{matrix}2\\text{NO}\\rm ($条件为放电也是正确的$\\rm )$
"]]汽车发动机内燃油燃烧产生高温,高温下氮气和氧气反应生成$\text{NO}$,化学方程式为${{\text{N}}_{2}}+{{\text{O}}_{2}}\begin{matrix} \underline{\underline{高温}} \\ {} \\\end{matrix}2\text{NO}$;
在工业上有多种方法处理氮氧化物:
$\rm I$.碱液吸收法:利用石灰乳吸收氮氧化物$ (\text{N}{{\text{O}}_{x}} )$,既能改善大气环境,又能获得应用广泛的$\text{Ca}{{\left( \text{N}{{\text{O}}_{\text{2}}} \right)}_{\text{2}}}$,其部分工艺流程如下:
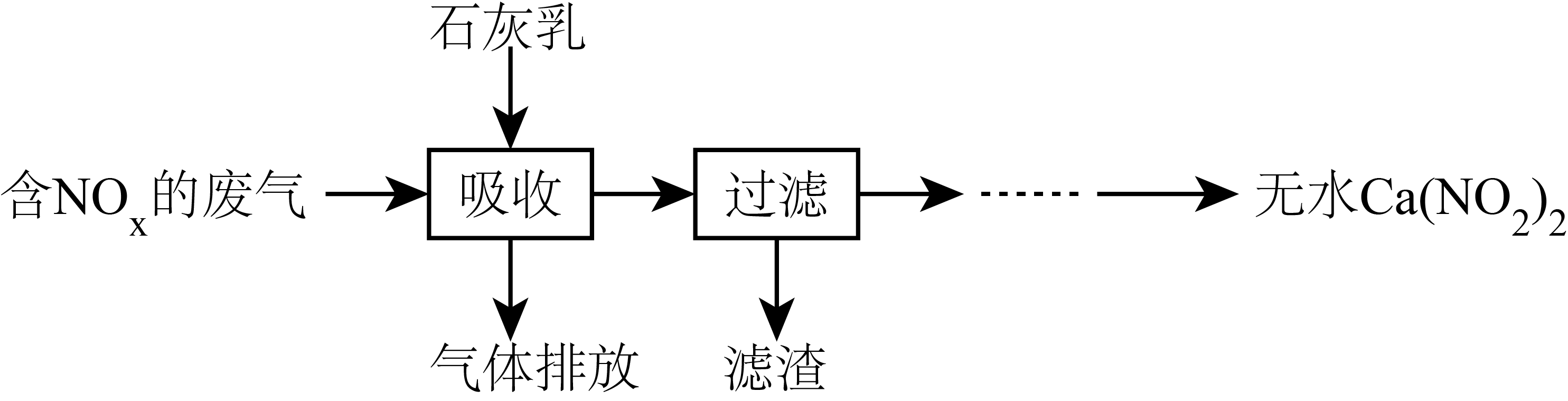
①上述工艺中采用气$\rm —$液逆流接触吸收$\rm ($即尾气从吸收塔底进入,从吸收塔顶喷淋石灰乳$\rm )$,其目的是 。
②生产中溶液需保持弱碱性,原因是$\text{Ca}{{\left( \text{N}{{\text{O}}_{2}} \right)}_{2}}$会在酸性溶液中自发反应,产物只有一种气体:$\rm NO$,上述反应的离子方程式为 。
$\rm I$$\rm I$.还原剂还原法:催化剂$\rm M$能催化氨气与$\text{N}{{\text{O}}_{x}}$反应生成${{\text{N}}_{2}}$。
已知:$4\text{N}{{\text{H}}_{3}}(\text{g})+3{{\text{O}}_{2}}(\text{g})=2{{\text{N}}_{2}}(\text{g})+6{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H=-1530\text{ kJ}/\text{mol}$,
${{\text{N}}_{2}}(\text{g})+{{\text{O}}_{2}}(\text{g})=2\text{NO}(\text{g})\quad \Delta H=+180\text{ kJ}/\text{mol}$
③写出$\text{N}{{\text{H}}_{3}}$还原$\rm NO$的热化学方程式: 。
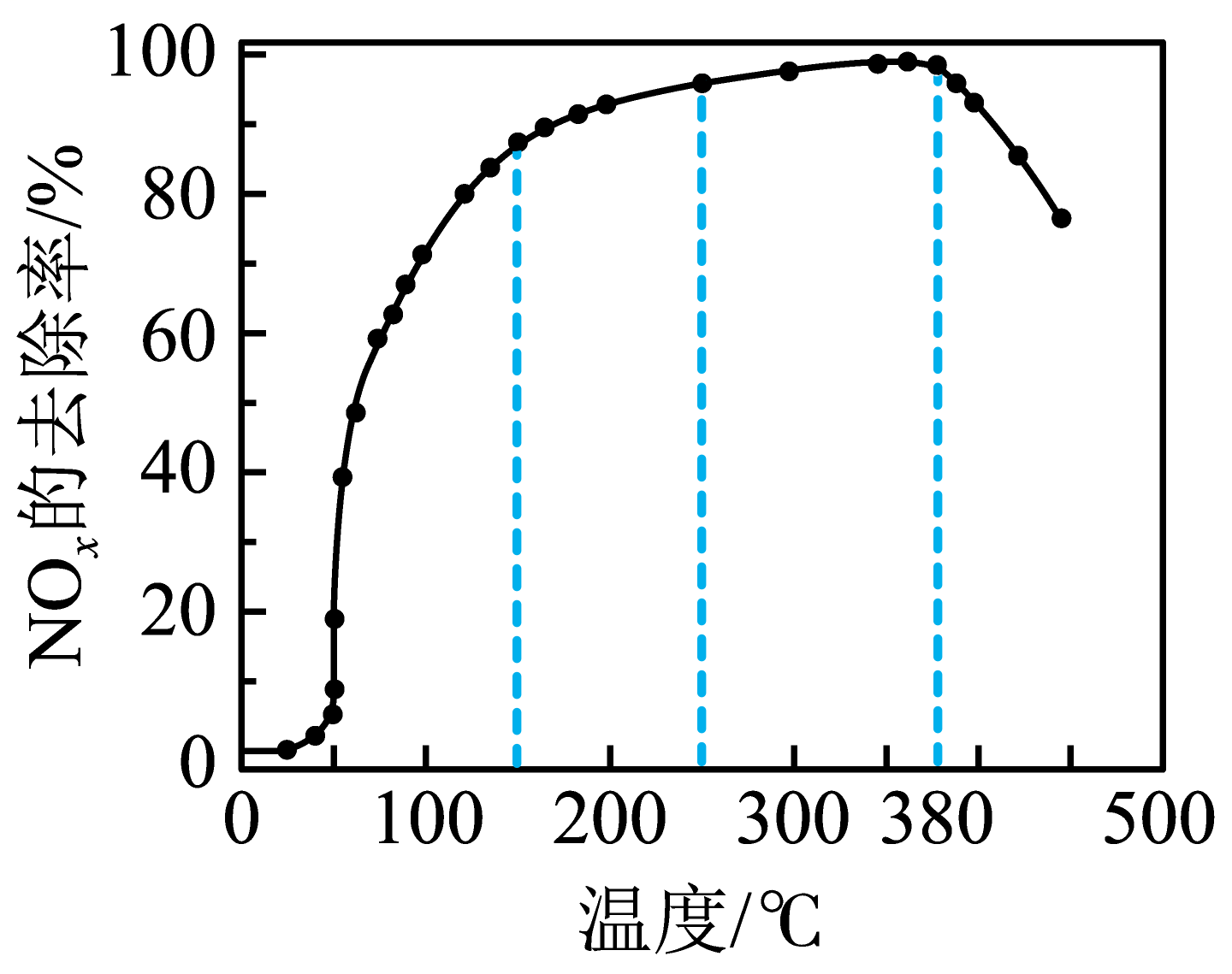
④将一定比例的${{\text{O}}_{2}}$、$\text{N}{{\text{H}}_{3}}$和$\rm NO$的混合气体,匀速通入装有催化剂$\rm M$的反应器中反应。相同时间内,$\rm NO$去除率随反应温度变化曲线如图所示。在$\rm 50$~$\rm 150$ $\rm ^\circ\rm C$范围内,随温度升高,$\rm NO$去除率上升的可能原因是 。
$\rm II$$\rm I$.电化学法:
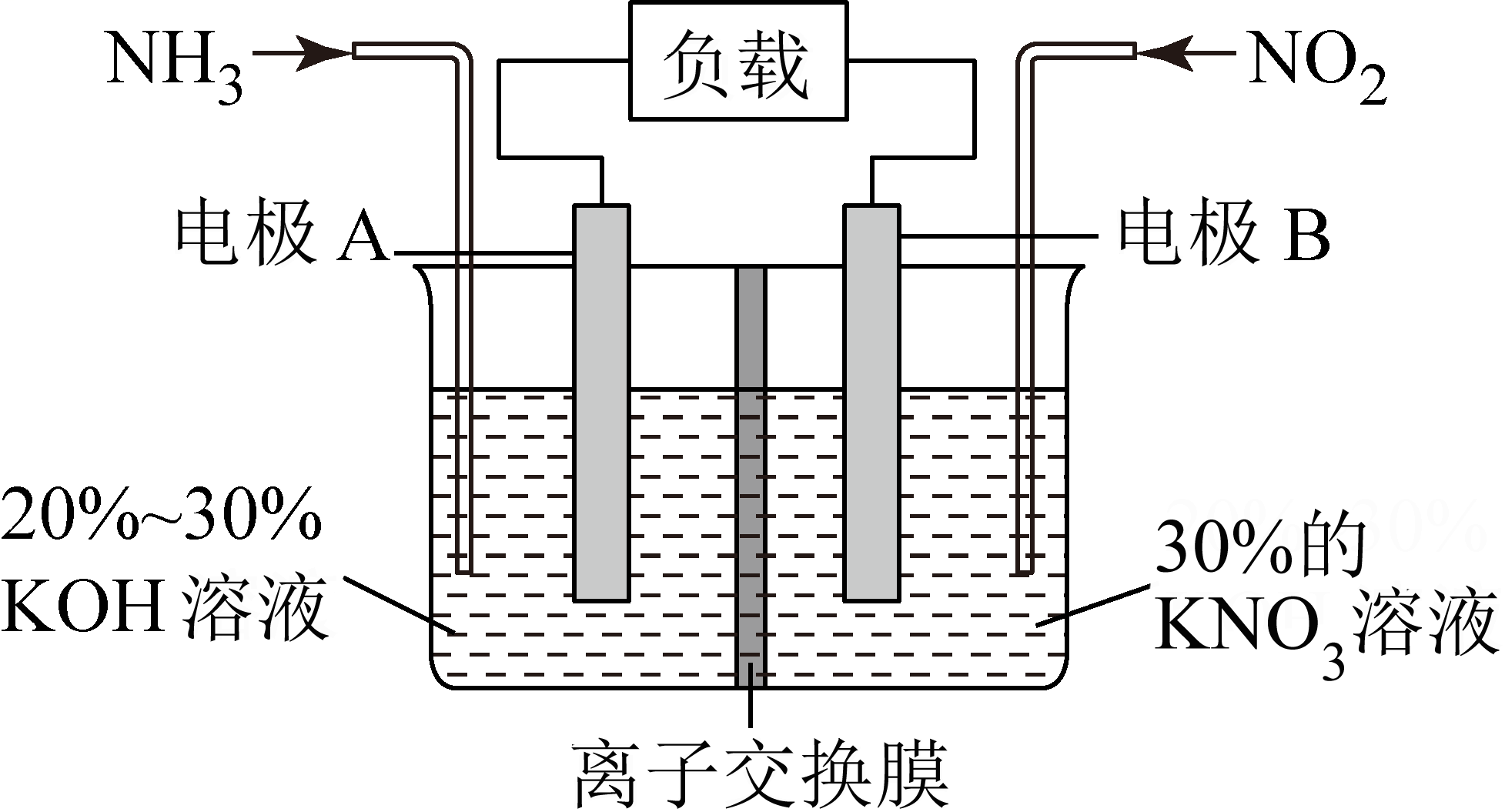
⑤利用反应$6\text{N}{{\text{O}}_{2}}+8\text{N}{{\text{H}}_{3}}=7{{\text{N}}_{2}}+12{{\text{H}}_{2}}\text{O}$构成电池,能实现有效控制氮氧化物的排放,减轻环境污染,装置如图所示。其中$\rm A$电极为电池 极,电极$\rm B$的电极反应式为 $\rm .$
使尾气中$\\text{NO}$、$\\text{N}{{\\text{O}}_{2}}$与石灰乳充分接触,$\\text{NO}$、$\\text{N}{{\\text{O}}_{2}}$被充分吸收 ; $3\\text{NO}_{2}^{-}+2{{\\text{H}}^{+}}=\\text{NO}_{3}^{-}+2\\text{NO}\\uparrow +{{\\text{H}}_{2}}\\text{O}$ ; $4\\text{N}{{\\text{H}}_{3}}(\\text{g})+6\\text{NO}(\\text{g})=5{{\\text{N}}_{2}}(g)+6{{\\text{H}}_{2}}\\text{O}(\\text{g})\\quad \\Delta H=-2070\\text{ kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$ ; 在该温度范围内,催化剂的活性大,故反应速率大,则相同时间内,$\\text{NO}$的去除率增大,或温度升高导致速率加快,$\\text{NO}$去除率增大 ; 负 ; $2\\text{N}{{\\text{O}}_{2}}+8{{\\text{e}}^{-}}+4{{\\text{H}}_{2}}\\text{O}=8\\text{O}{{\\text{H}}^{-}}+{{\\text{N}}_{2}}$
"]]①上述工艺中采用气$\rm —$液逆流接触吸收的目的是:使尾气中$\text{NO}$、$\text{N}{{\text{O}}_{2}}$与石灰乳充分接触,$\text{NO}$、$\text{N}{{\text{O}}_{2}}$被充分吸收;
②生产中溶液需保持弱碱性,在酸性溶液中$\text{Ca}{{\left( \text{N}{{\text{O}}_{2}} \right)}_{2}}$会发生自发反应,则反应物为亚硝酸根离子和氢离子,产物是$\text{NO}$、硝酸根离子和水,根据氧化还原反应方程式书写规则,反应的离子方程式为$3\text{NO}_{2}^{-}+2{{\text{H}}^{+}}=\text{NO}_{3}^{-}+2\text{NO}\uparrow +{{\text{H}}_{2}}\text{O}$;
③已知:反应$\rm i$:$4\text{N}{{\text{H}}_{3}}(\text{g})+3{{\text{O}}_{2}}(\text{g})=2{{\text{N}}_{2}}(\text{g})+6{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{1}}=-1530\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,
反应$\rm ii$:${{\text{N}}_{2}}(\text{g})+{{\text{O}}_{2}}(\text{g})=2\text{NO}(\text{g})\quad \Delta {{H}_{2}}=+180\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
按盖斯定律,$\rm i-3\times \rm ii$得到$\text{N}{{\text{H}}_{3}}$还原$\text{NO}$热化学方程式:$4\text{N}{{\text{H}}_{3}}(\text{g})+6\text{NO}(\text{g})=5{{\text{N}}_{2}}(\text{g})+6{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H=\Delta {{H}_{1}}-3\Delta {{H}_{2}}=-1530\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}-3\times 180\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}=-2070\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,则热化学方程式为$4\text{N}{{\text{H}}_{3}}(\text{g})+6\text{NO}(\text{g})=5{{\text{N}}_{2}}(g)+6{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H=-2070\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
④将一定比例的${{\text{O}}_{2}}$、$\text{N}{{\text{H}}_{3}}$和$\text{NO}$的混合气体,匀速通入装有催化剂$\rm M$的反应器中反应。反应未达到平衡状态,脱氮率取决于速率,温度越高速率越快,所以脱氮率增大,在$\rm 50$~$\rm 150\;\rm ^\circ\rm C$范围内随着温度的升高,$\text{NO}$的去除率上升的原因可能是:温度升高,反应速率增大,故相同时间内,$\text{NO}$的去除率增大或在该温度范围内,催化剂的活性大,则反应速率大,相同时间内$\text{NO}$去除率增大;
⑤该装置为原电池,由图知:电极$\rm A$上$\rm NH_{3}$发生氧化反应得到$\rm N_{2}$,故$\rm A$为负极;$\rm B$极通入的是$\text{N}{{\text{O}}_{2}}$,由方程式$6\text{N}{{\text{O}}_{2}}+8\text{N}{{\text{H}}_{3}}=7{{\text{N}}_{2}}+12{{\text{H}}_{2}}\text{O}$可知$\text{N}{{\text{O}}_{2}}$在$\rm B$极得电子被还原生成氮气,在硝酸钾溶液作电解质溶液的条件下,发生的电极反应为$2\text{N}{{\text{O}}_{2}}+8{{\text{e}}^{-}}+4{{\text{H}}_{2}}\text{O}=8\text{O}{{\text{H}}^{-}}+{{\text{N}}_{2}}$。
高中 | 氮气的结构、性质和用途题目答案及解析(完整版)
