高中 | 偏铝酸盐的化学性质 题目答案及解析
稿件来源:高途
高中 | 偏铝酸盐的化学性质题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
偏铝酸盐的化学性质
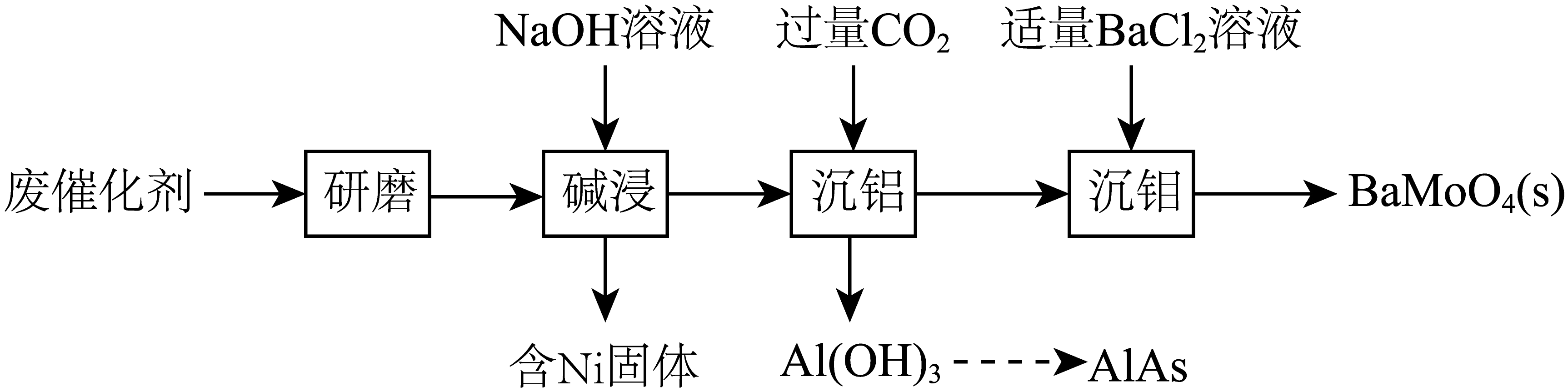
一种回收利用某废催化剂$\rm [$主要含铝$\rm (Al)$、钼$\rm (Mo)$、镍$\rm (Ni)$等元素的氧化物$\rm ]$中$\rm Al$、$\rm Mo$的工艺流程如下:
回答下列问题:
“研磨”的目的是 。
增大接触面积,加快反应速率,使反应更充分
"]]“研磨”的目的是增大接触面积,加快反应速率,使反应更充分。
“碱浸”中,有$\text{N}{{\text{a}}_{2}}\text{Mo}{{\text{O}}_{4}}$生成,其中$\rm Mo$元素的化合价为 。
$\\rm +6$
"]]“碱浸”中,有$\text{N}{{\text{a}}_{2}}\text{Mo}{{\text{O}}_{4}}$生成,其中$\text{Mo}$元素的化合价为$\rm +6$价。
“沉铝”中,发生反应的离子方程式为 。“沉钼”中,发生反应的离子方程式为 。
${{\\left[ \\text{Al}{{(\\text{OH})}_{4}} \\right]}^{-}}+\\text{C}{{\\text{O}}_{2}}=\\text{Al}{{(\\text{OH})}_{3}}\\downarrow +\\text{HCO}_{3}^{-}$;$\\text{B}{{\\text{a}}^{2+}}+\\text{MoO}_{4}^{2-}=\\text{BaMo}{{\\text{O}}_{4}}\\downarrow $
"]]“沉铝”中,通入过量的二氧化碳,发生反应的离子方程式为:${{\left[ \text{Al}{{(\text{OH})}_{4}} \right]}^{-}}+\text{C}{{\text{O}}_{2}}=\text{Al}{{(\text{OH})}_{3}}\downarrow +\text{HCO}_{3}^{-}$。“沉钼”中,反应的离子方程式为:$\text{B}{{\text{a}}^{2+}}+\text{MoO}_{4}^{2-}=\text{BaMo}{{\text{O}}_{4}}\downarrow $。
“沉钼”后所得滤液中主要存在的钠盐有$\rm NaCl$和$\rm Y$,$\rm Y$受热分解可制得纯碱,$\rm Y$为 。
$\\rm NaHCO_{3}$
"]]“沉铝”后生成$\text{HCO}_{3}^{-}$,故“沉锄”后所得滤液中主要存在的钠盐有$\text{NaCl}$和$\text{NaHC}{{\text{O}}_{3}}$,$\text{NaHC}{{\text{O}}_{3}}$受热分解可制得纯碱。
高纯$\rm AIAs($砷化铝$\rm )$可用于芯片制造。芯片制造中的一种刻蚀过程如图所示。
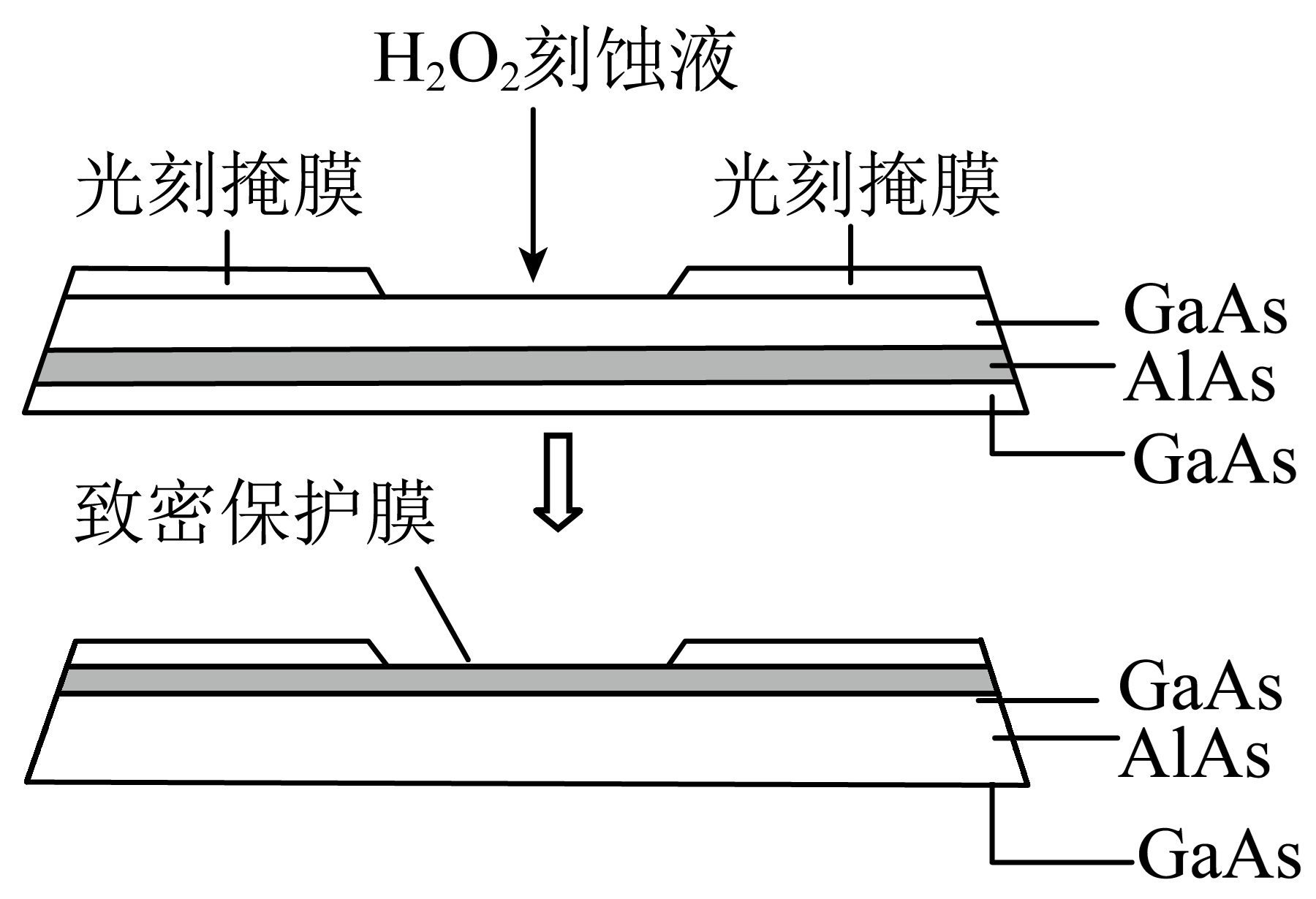
①已知:$\rm Ga$和$\rm Al$同族,$\rm As$和$\rm N$同族。在${{\text{H}}_{2}}{{\text{O}}_{2}}$与上层$\rm GaAs$的反应中,$\rm As$元素的化合价变为$\rm +5$价,则该反应的氧化剂与还原剂物质的量之比为 。
②图中所示致密保护膜为一种氧化物,可阻止${{\text{H}}_{2}}{{\text{O}}_{2}}$刻蚀液与下层$\rm GaAs$反应,该氧化物为 。
$\\rm 4: 1$;$\\rm Al_{2}O_{3}$
"]]${{\text{H}}_{2}}{{\text{O}}_{2}}$与$\text{GaAs}$的反应,$\text{GaAs}$中$\text{As}$元素的化合价由$\rm -3$价氧化为$\rm +5$价,作还原剂,过氧化氢中氧元素化合价由$\rm -1$价还原为$\rm -2$价,作氧化剂,则该反应的氧化剂与还原剂物质的量之比为$4:1$;结合图示信息,从元素守恒的角度,致密保护膜为$\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$。
高中 | 偏铝酸盐的化学性质题目答案及解析(完整版)
