高中 | 金属的电化学防护 题目答案及解析
稿件来源:高途
高中 | 金属的电化学防护题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第四节 金属的电化学腐蚀与防护
金属的电化学防护
甲、乙同学分别用图所示装置验证铁的电化学防腐,相同时间后进行如下实验。
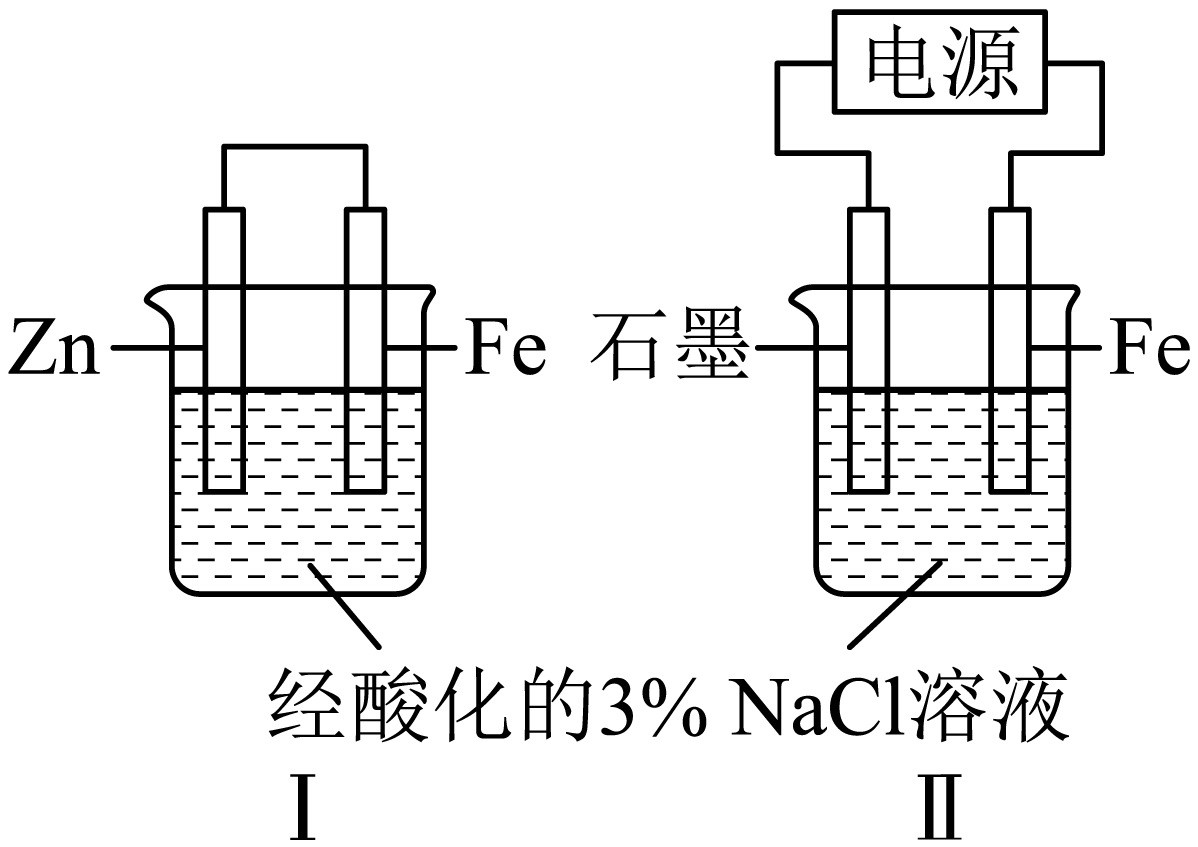
实验①:甲同学分别向Ⅰ、Ⅱ中$\rm Fe$电极附近滴加$\rm {{K}_{3}}\left[ Fe{{(CN)}_{6}} \right]$溶液,Ⅰ中产生蓝色沉淀,Ⅱ中无沉淀。
实验②:乙同学分别取Ⅰ、Ⅱ中$\rm Fe$电极附近溶液,滴加$\rm {{K}_{3}}\left[ Fe{{(CN)}_{6}} \right]$溶液,Ⅰ、Ⅱ中均无沉淀。
下列说法不正确的是$\rm (\qquad)$
Ⅰ是牺牲阳极保护法,正极反应式可能为$\\rm {{O}_{2}}+4{{H}^{+}}+4{{e}^{-}}=2{{H}_{2}}O$
","Ⅱ为外加电流阴极保护法,$\\rm Fe$电极与外接电源的负极相连
","由实验①中Ⅰ、Ⅱ现象的差异,推测$\\rm {{K}_{3}}\\left[ Fe{{(CN)}_{6}} \\right]$在Ⅰ中氧化性强于Ⅱ
","由实验可知,两种保护法均能保护$\\rm Fe$,且Ⅱ保护得更好
"]$\rm A$.由图可知,$\rm Fe$电极是正极,$\rm Zn$电极是负极,属于牺牲阳极的阴极保护法,由于电解质溶液呈酸性,故正极上在氢离子参与下氧气得电子,正极反应可能为:$\rm {{O}_{2}}+4{{H}^{+}}+4{{e}^{-}}=2{{H}_{2}}O$,$\rm A$正确。
$\rm B$.外加电流阴极保护法中要保护的电极应与外接电源的负极相连,即$\rm Fe$电极与外接电源的负极相连,$\rm B$正确。
$\rm C$.由于Ⅰ中$\rm Fe$电极与电解质溶液直接接触,会有少量的$\rm Fe$直接与酸反应生成$\rm Fe^{2+}$,而Ⅱ中铁为阴极,难以失去电子,由实验②现象可知,均无沉淀,说明反应与$\rm K_{3}[Fe(CN)_{6}]$在Ⅰ、Ⅱ中的氧化性无关,$\rm C$错误。
$\rm D$.对比Ⅰ、Ⅱ现象的差异可知,两种保护法均能保护$\rm Fe$,且电解法保护的更好,即Ⅱ保护得更好,$\rm D$正确。
故选:$\rm C$
高中 | 金属的电化学防护题目答案及解析(完整版)
