| 氯气 题目答案及解析
稿件来源:高途
| 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
浩瀚的海洋里蕴藏着丰富的化学资源。利用海水可以提取溴和镁,提取过程如下:
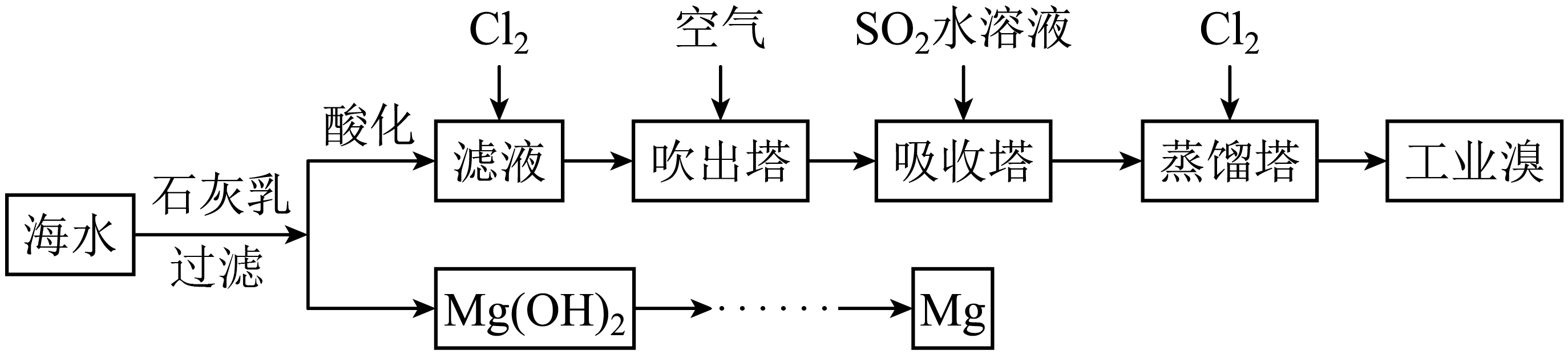
已知$\rm AgBr$是淡黄色且不溶于硝酸的难溶物。
氯元素在周期表中的位置是 。
第三周期Ⅶ$\\rm A$族
"]]氯元素在周期表中的位置是第三周期Ⅶ$\rm A$族;
提取溴的过程中,滤液中通入$\text{C}{{\text{l}}_{2}}$生成$\text{B}{{\text{r}}_{\text{2}}}$的离子方程式 。经过$\rm 2$次$\mathrm{Br}^{-} \rightarrow \mathrm{Br}_{2}$转化的目的是 。
$\\rm Cl_{2}+2Br^{-}=Br_{2}+2Cl^{-}$ ; 富集溴元素
"]]滤液中通入$\text{C}{{\text{l}}_{2}}$生成$\text{B}{{\text{r}}_{\text{2}}}$的离子方程式$\rm Cl_{2}+2Br^{-}=Br_{2}+2Cl^{-}$;根据分析,可知提取溴的过程中,经过$\rm 2$次$\rm Br^{-}→Br_{2}$转化的目的是富集溴元素;
设计能证明$\text{S}{{\text{O}}_{2}}$水溶液能够还原$\text{B}{{\text{r}}_{\text{2}}}$的实验方案 。
取反应后适量溶液,加入氯化钡溶液,生成白色沉淀,则证明$\\text{S}{{\\text{O}}_{2}}$水溶液能够还原$\\text{B}{{\\text{r}}_{\\text{2}}}$
"]]吸收塔中发生反应$\rm SO_{2}$将$\rm Br_{2}$还原,离子方程式是$\rm SO_{2}+2H_{2}O+Br_{2}=4H^{+}+2Br^{-}+SO_{4}^{2-}$,则取反应后适量溶液,加入氯化钡溶液,生成白色沉淀,则证明$\text{S}{{\text{O}}_{2}}$水溶液能够还原$\text{B}{{\text{r}}_{\text{2}}}$;
通过将$\text{Mg}{{(\text{OH})}_{2}}$转化为无水$\text{MgC}{{\text{l}}_{2}}$以制备单质$\rm Mg$,无水$\text{MgC}{{\text{l}}_{2}}$制取单质$\rm Mg$的化学方程式是 。
$\\text{MgC}{{\\text{l}}_{2}}\\begin{matrix} \\underline{\\underline{电解}} \\\\ {} \\\\\\end{matrix}\\text{Mg}+\\text{C}{{\\text{l}}_{\\text{2}}}\\uparrow $
"]]无水$\text{MgC}{{\text{l}}_{2}}$制取单质$\rm Mg$的化学方程式是$\text{MgC}{{\text{l}}_{2}}\begin{matrix} \underline{\underline{电解}} \\ {} \\\end{matrix}\text{Mg}+\text{C}{{\text{l}}_{\text{2}}}\uparrow $
;
工业上常用上述流程“空气吹出法”实现海水提溴,将$1{{\text{m}}^{3}}$海水浓缩至$\rm 1$ $\rm L$,使用该法最终得到$\text{36}\,\text{g B}{{\text{r}}_{2}}$,若提取率为$\rm 60\%$,则原海水中溴的浓度为 $\text{mg}/\text{L}$。
$\\rm 60$ $\\rm mg/L$
"]]使用该法最终得到$\rm 36$ $\rm g$ $\rm Br_{2}$,则$\rm Br$原子的质量为$\rm 36$ $\rm g$,提取率为$\rm 60\%$,原海水中的$\rm Br$原子的质量为$\rm 36$ $\rm g\div 60\%=60$ $\rm g$,则原海水中溴的浓度为$\rm 60\times 1000$ $\rm mg\div 1000\;\rm L=60$ $\rm mg/L$。
| 氯气题目答案及解析(完整版)
