| 杂化轨道理论 题目答案及解析
稿件来源:高途
| 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
钙钛矿$\rm (\text{CaTi}{{\text{O}}_{3}}\rm )$型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
Ⅰ.$\text{TiC}{{\text{l}}_{4}}$为制备$\text{CaTi}{{\text{O}}_{3}}$的一种原料。
$\rm Ti$的四卤化物熔点如下表所示,$\text{Ti}{{\text{F}}_{4}}$熔点高于其他三种卤化物,自$\text{TiC}{{\text{l}}_{4}}$至$\text{Ti}{{\text{I}}_{4}}$熔点依次升高,原因是 。
| 化合物 | $\text{Ti}{{\text{F}}_{4}}$ | $\text{TiC}{{\text{l}}_{4}}$ | $\text{TiB}{{\text{r}}_{4}}$ | $\text{Ti}{{\text{I}}_{4}}$ |
| 熔点$/\ {}^\circ \text{C}$ | $\rm 377$ | $-24.12$ | $38.3$ | $\rm 155$ |
$\\text{Ti}{{\\text{F}}_{4}}$为离子晶体,熔点高,其他三种均为分子晶体,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
"]]$\text{Ti}{{\text{F}}_{4}}$熔点高于其他三种卤化物,自$\text{TiC}{{\text{l}}_{4}}$至$\text{Ti}{{\text{I}}_{4}}$熔点依次升高,原因是$\text{Ti}{{\text{F}}_{4}}$为离子晶体,熔点高,其他三种均为分子晶体,随相对分子质量的增大分子间作用力增大,熔点逐渐升高。
Ⅱ.一类有机一无机杂化材料$\text{C}{{\text{H}}_{3}}\text{N}{{\text{H}}_{3}}\text{Pb}{{\text{I}}_{3}}$具有与$\text{CaTi}{{\text{O}}_{3}}$相同的晶体结构。
①有机阳离子$\text{C}{{\text{H}}_{3}}\text{NH}_{3}^{+}$中$\rm C$原子和$\rm N$原子的电负性大小比较:$\rm C$ $\rm N($填“$\lt $”、“$=$”或“$\gt $”$\rm )$,从原子结构的角度说明理由 。
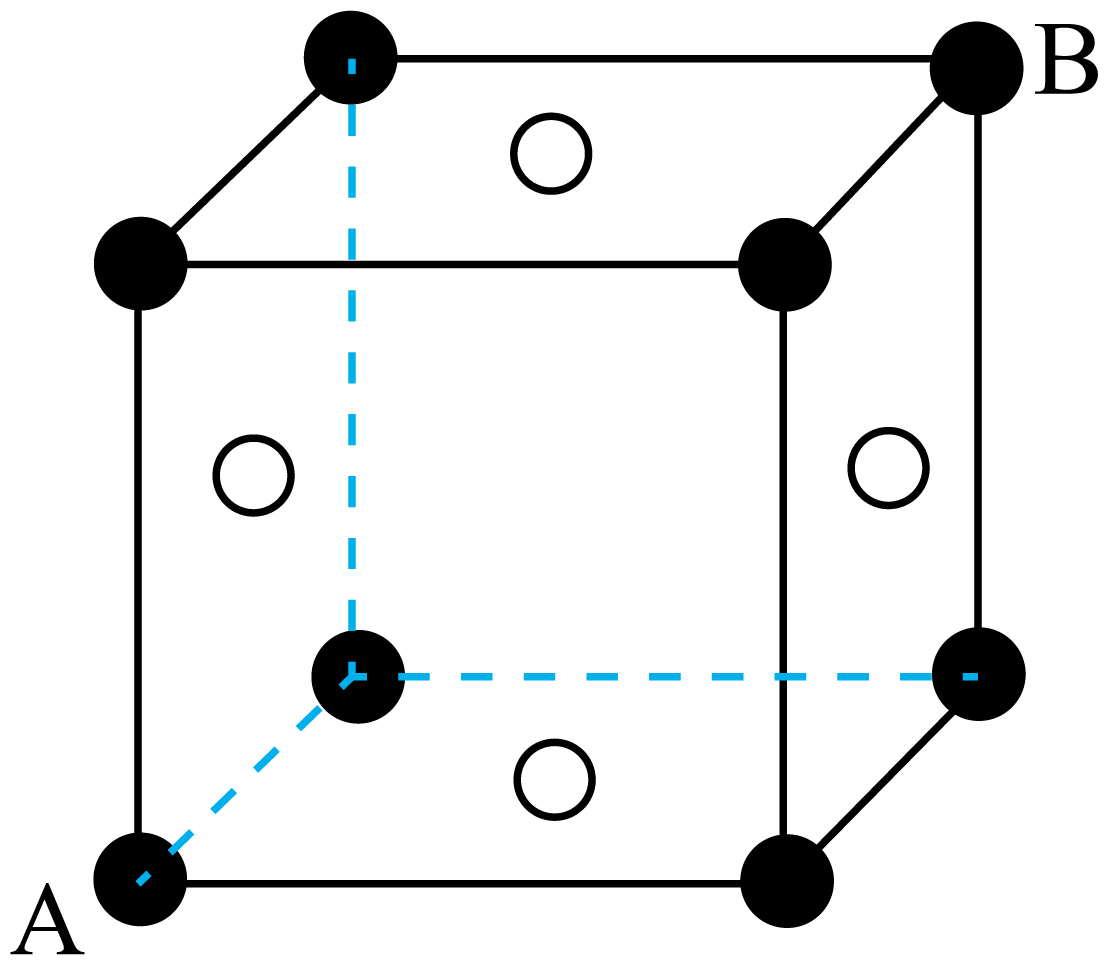
②若将晶胞中的$\rm A$坐标定义为$\left( 0,0,0 \right)$,$\rm B$坐标定义为$\left( 1,1,1 \right)$,则离$\rm A$最近的微粒的坐标为 $\rm ($任写其一$\rm )$。若将晶胞中心微粒的坐标定义为$\left( 0,0,0 \right)$,则与其紧邻的$\mathrm{I}^{-}$的坐标为 $\rm ($任写其一$\rm )$。
③$\text{H}-\text{N}-\text{H}$键角大小比较:$\text{C}{{\text{H}}_{3}}\text{NH}_{3}^{+}$ $\text{C}{{\text{H}}_{3}}\text{N}{{\text{H}}_{2}}\rm ($填“$\lt $”、“$=$”或“$\gt $”$\rm )$,原因是 。
$\\lt $ ; $\\rm C$、$\\rm N$原子处于同一周期,电子层数相同,核电荷数$\\text{C}\\lt \\text{N}$,原子半径$\\text{C}\\gt \\text{N}$,形成化学键时$\\rm C$原子吸引电子的能力弱,电负性$\\text{C}\\lt \\text{N}$ ; $\\left( 1/2,1/2,0 \\right)$或$\\left( 1/2,0,1/2 \\right)$或$\\left( 0,1/2,1/2 \\right)$ ; $\\left( 1/2,0,0 \\right)$或$\\left( 0,1/2,0 \\right)$或$\\left( 0,0,1/2 \\right)$ ; $\\gt $ ; $\\text{C}{{\\text{H}}_{3}}\\text{NH}_{3}^{+}$和$\\text{C}{{\\text{H}}_{3}}\\text{N}{{\\text{H}}_{2}}$中的$\\rm N$原子均为$\\text{s}{{\\text{p}}^{\\text{3}}}$杂化,$\\text{C}{{\\text{H}}_{3}}\\text{NH}_{3}^{+}$中$\\rm N$原子无孤电子对,$\\text{C}{{\\text{H}}_{3}}\\text{N}{{\\text{H}}_{2}}$中$\\rm N$原子有一对孤电子对,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力
"]]①有机阳离子$\text{C}{{\text{H}}_{3}}\text{NH}_{3}^{+}$中$\rm C$原子和$\rm N$原子的电负性大小比较:$\rm C\lt \rm N$,从原子结构的角度说明理由:$\rm C$、$\rm N$原子处于同一周期,电子层数相同,核电荷数$\text{C}\lt \text{N}$,原子半径$\text{C}\gt \text{N}$,形成化学键时$\rm C$原子吸引电子的能力弱,电负性$\text{C}\lt \text{N}$。
②若将晶胞中的$\rm A$坐标定义为$\left( 0,0,0 \right)$,$\rm B$坐标定义为$\left( 1,1,1 \right)$,则过$\rm A$点的三个相互垂直的面面心的三个点离$\rm A$最近,微粒的坐标为$\left( 1/2,1/2,0 \right)$或$\left( 1/2,0,1/2 \right)$或$\left( 0,1/2,1/2 \right)\rm ($任写其一$\rm )$。若将晶胞中心微粒的坐标定义为$\left( 0,0,0 \right)$,则与其紧邻的$\mathrm{I}^{-}$的坐标为$\left( 1/2,0,0 \right)$或$\left( 0,1/2,0 \right)$或$\left( 0,0,1/2 \right)$,如图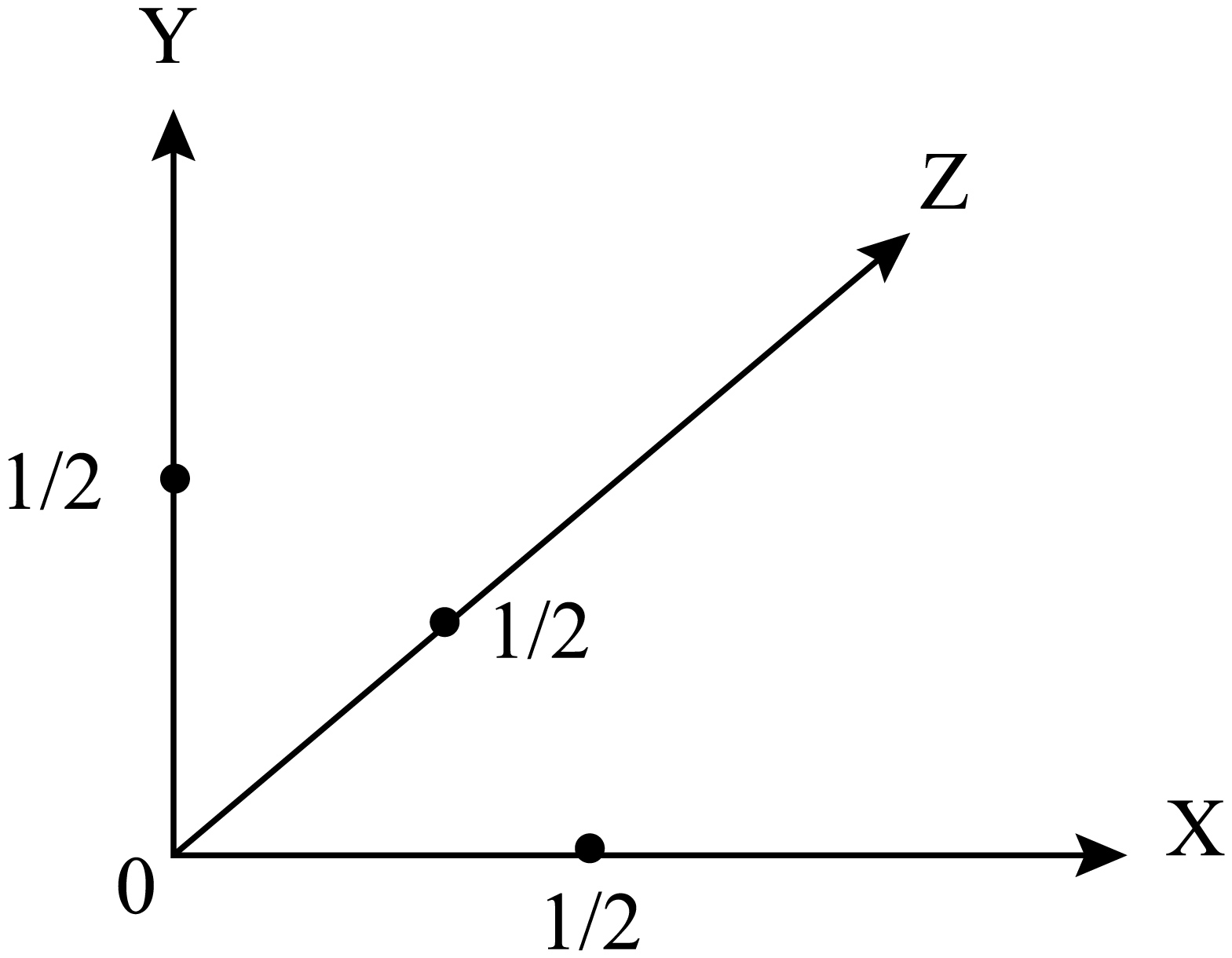 。
。
③$\text{H}-\text{N}-\text{H}$键角大小比较:$\text{C}{{\text{H}}_{3}}\text{NH}_{3}^{+}\gt \text{C}{{\text{H}}_{3}}\text{N}{{\text{H}}_{2}}$,原因是$\text{C}{{\text{H}}_{3}}\text{NH}_{3}^{+}$和$\text{C}{{\text{H}}_{3}}\text{N}{{\text{H}}_{2}}$中的$\rm N$原子均为$\text{s}{{\text{p}}^{\text{3}}}$杂化,$\text{C}{{\text{H}}_{3}}\text{NH}_{3}^{+}$中$\rm N$原子无孤电子对,$\text{C}{{\text{H}}_{3}}\text{N}{{\text{H}}_{2}}$中$\rm N$原子有一对孤电子对,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力。
$\text{C}{{\text{H}}_{3}}\text{N}{{\text{H}}_{3}}\text{Pb}{{\text{I}}_{3}}$晶体生长过程中容易产生晶体缺陷,造成$\mathrm{I}^{-}$空位。用$\text{B}{{\text{r}}^{-}}$替换$\mathrm{I}^{-}$可改善这种情况的可能原因是 。
$\\text{B}{{\\text{r}}^{-}}$的半径小于$\\mathrm{I}^{-}$,使阴离子与阳离子间的离子间距变小,作用力增大,不易产生空位
"]]$\text{C}{{\text{H}}_{3}}\text{N}{{\text{H}}_{3}}\text{Pb}{{\text{I}}_{3}}$晶体生长过程中容易产生晶体缺陷,造成$\mathrm{I}^{-}$空位。用$\text{B}{{\text{r}}^{-}}$替换$\mathrm{I}^{-}$可改善这种情况的可能原因是$\text{B}{{\text{r}}^{-}}$的半径小于$\mathrm{I}^{-}$,使阴离子与阳离子间的离子间距变小,作用力增大,不易产生空位。
| 杂化轨道理论题目答案及解析(完整版)
