高中 | 氯气的制法 题目答案及解析
稿件来源:高途
高中 | 氯气的制法题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气的制法
某小组探究$\text{AgN}{{\text{O}}_{3}}$溶液对氯水漂白性的影响,部分装置如下图所示。
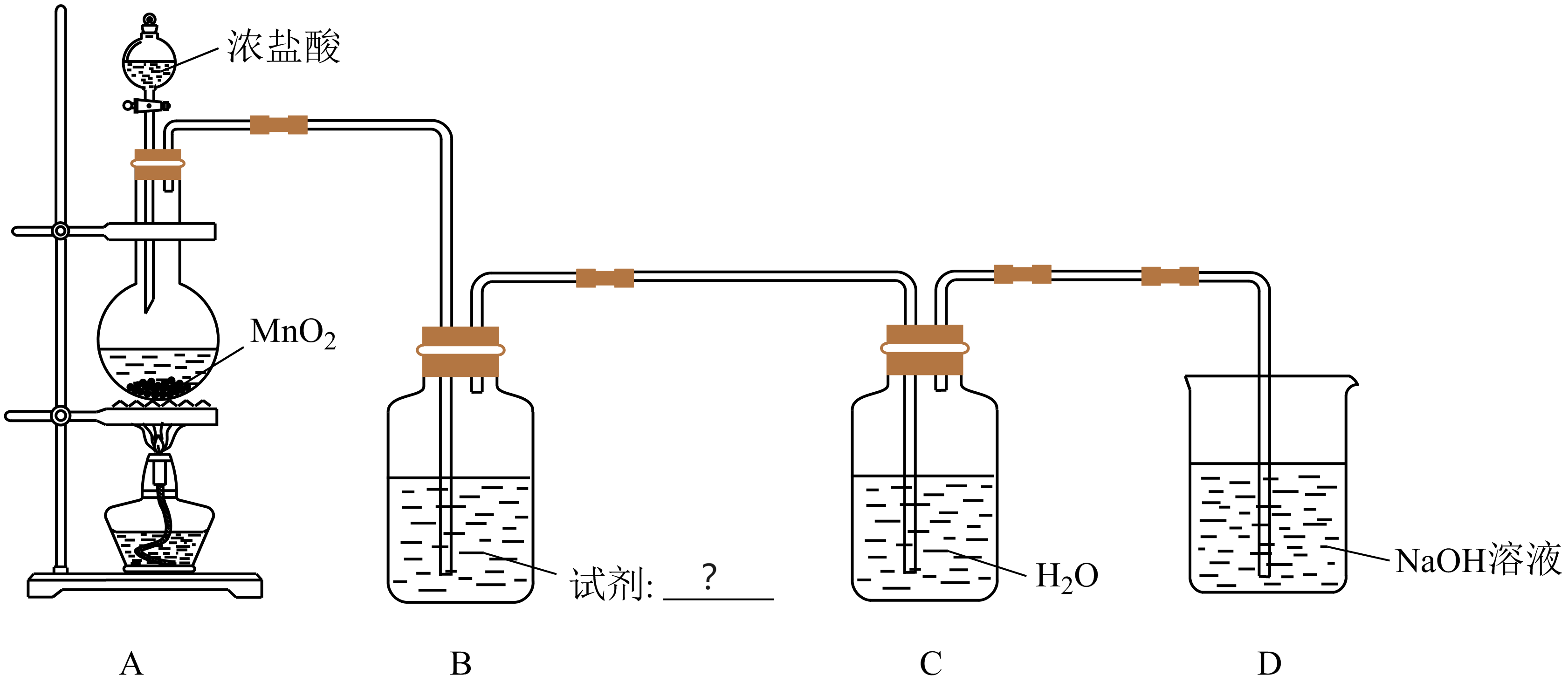
$\rm A$中反应的离子方程式是 。
$\\text{Mn}{{\\text{O}}_{2}}+4{{\\text{H}}^{+}}+2\\text{C}{{\\text{l}}^{-}}\\begin{array}{c} {\\underline{\\underline{\\triangle}}}\\\\{} \\end{array}\\text{M}{{\\text{n}}^{2+}}+2{{\\text{H}}_{2}}\\text{O}+\\text{C}{{\\text{l}}_{2}}\\uparrow $
"]]装置$\rm A$为制取氯气的装置,其反应的离子方程式为$\text{Mn}{{\text{O}}_{2}}+4{{\text{H}}^{+}}+2\text{C}{{\text{l}}^{-}}\begin{array}{c} {\underline{\underline{\triangle}}}\\{} \end{array}\text{M}{{\text{n}}^{2+}}+2{{\text{H}}_{2}}\text{O}+\text{C}{{\text{l}}_{2}}\uparrow $;
$\rm B$中试剂是 ,其作用为 。
饱和$\\text{NaCl}$溶液 ;除去$\\text{C}{{\\text{l}}_{2}}$混有的$\\text{HCl}$气体
"]]浓盐酸具有挥发性,生成的氯气中含有少量$\rm HCl$气体,为了防止$\rm HCl$对实验干扰,装置$\rm B$中的为饱和食盐水,用于除去氯气中混有的$\rm HCl$。
取$\rm C$中氯水,进行实验:向试管Ⅰ和Ⅱ中各加入$\rm 1\;\rm mL$氯水:
| 序号 | 所加试剂 | 现象 |
| Ⅰ | $\rm 1$滴品红$\rm +a$ | 几秒后品红褪色 |
| Ⅱ | $\rm 1$滴品红$\rm +1\;\rm mL\ \text{AgN}{{\text{O}}_{3}}$溶液 | 几分钟后品红褪色,产生白色沉淀 |
试管Ⅰ中所加试剂$\rm a$为 。
$\\rm 1\\;\\rm mL$蒸馏水
"]]根据实验②中加入了$\rm 1\;\rm mL$硝酸银溶液,又因为实验①的目的是排除稀释对品红褪色的影响,所以需要保持溶液体积不变,故试剂$\rm a$是$\rm 1\;\rm mL$水,故答案为:$\rm 1\;\rm mL$蒸馏水;
Ⅱ中品红褪色慢,推测可能发生了$\text{HClO}+\text{AgN}{{\text{O}}_{3}}\text{=AgClO}\downarrow +\text{HN}{{\text{O}}_{3}}$,导致Ⅱ中$\text{HClO}$减少。分析沉淀中含$\text{AgClO}$,探究如下:将沉淀滤出并用蒸馏水洗涤,然后向沉淀中加入盐酸,产生黄绿色气体。根据以上推测,产生黄绿色气体的离子方程式是 。
$\\text{AgClO}+2{{\\text{H}}^{+}}+2\\text{C}{{\\text{l}}^{-}}\\text{=AgCl}+{{\\text{H}}_{2}}\\text{O}+\\text{C}{{\\text{l}}_{2}}\\uparrow $
"]]将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体,发生反应$\text{AgClO}+2{{\text{H}}^{+}}+2\text{C}{{\text{l}}^{-}}\text{=AgCl}+{{\text{H}}_{2}}\text{O}+\text{C}{{\text{l}}_{2}}\uparrow $。
经查阅资料可知,$\text{AgClO}$具有一定的溶解性,一定条件下,其可以转化为更难溶的$\text{AgCl}$;据此,甲同学认为Ⅱ中溶液仍具有漂白性,可能是$\text{AgClO}$部分溶解后导致溶液具有漂白性,乙同学认为是因为所加$\text{AgN}{{\text{O}}_{3}}$溶液不足量;甲同学通过离子检验证明了乙同学的猜测不正确,其实验过程为 。
取少量Ⅱ中上清液于洁净试管中,加入两滴稀盐酸$\\rm ($或$\\text{NaCl}$溶液等$\\rm )$,观察到有白色沉淀生成
"]]要验证猜测可能是所加$\rm AgNO_{3}$溶液不足量使$\rm ClO^{-}$未完全沉淀,只需要证明溶液中有无次氯酸根离子即可,即取少量Ⅱ中上清液于洁净试管中,加入两滴稀盐酸$\rm ($或$\text{NaCl}$溶液等$\rm )$,观察到有白色沉淀生成,证实所加$\rm AgNO_{3}$溶液过量。
甲同学利用本探究实验中的试剂进一步证实Ⅱ中所得沉淀中含$\text{AgClO}$:向沉淀中加入饱和$\text{NaCl}$溶液,静置、过滤,滤渣、滤液备用;
①实验证实滤渣中无$\text{AgClO}$;
②取滤液, ;
以上实验说明,所得沉淀中含$\text{AgClO}$。
加入一滴品红$\\rm ($溶液$\\rm )$并振荡,溶液中的红色褪去
"]]向沉淀中加入饱和$\rm NaCl$溶液,发生反应为$\rm AgClO+NaCl=NaClO+AgCl↓$,滤渣为$\rm AgCl$,滤液中含有$\rm NaClO$,证明滤液中含有$\rm NaClO$的方法为:取滤液,加入一滴品红$\rm ($溶液$\rm )$并振荡,溶液中的红色褪去,说明滤液中含有$\rm NaClO$。
高中 | 氯气的制法题目答案及解析(完整版)
