| 盐类水解在生活中的应用 题目答案及解析
稿件来源:高途
| 盐类水解在生活中的应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解在生活中的应用
三氧化二镍$\rm (\text{N}{{\text{i}}_{\text{2}}}{{\text{O}}_{\text{3}}}\rm )$是重要的电子元件和蓄电池材料,工业上利用含镍废料$\rm ($主要含$\text{Ni}$、$\text{Al}$、$\text{Fe}$的氧化物,$\text{Si}{{\text{O}}_{\text{2}}}$,$\rm C$等$\rm )$制备$\text{N}{{\text{i}}_{\text{2}}}{{\text{O}}_{\text{3}}}$的工艺流程如下所示:
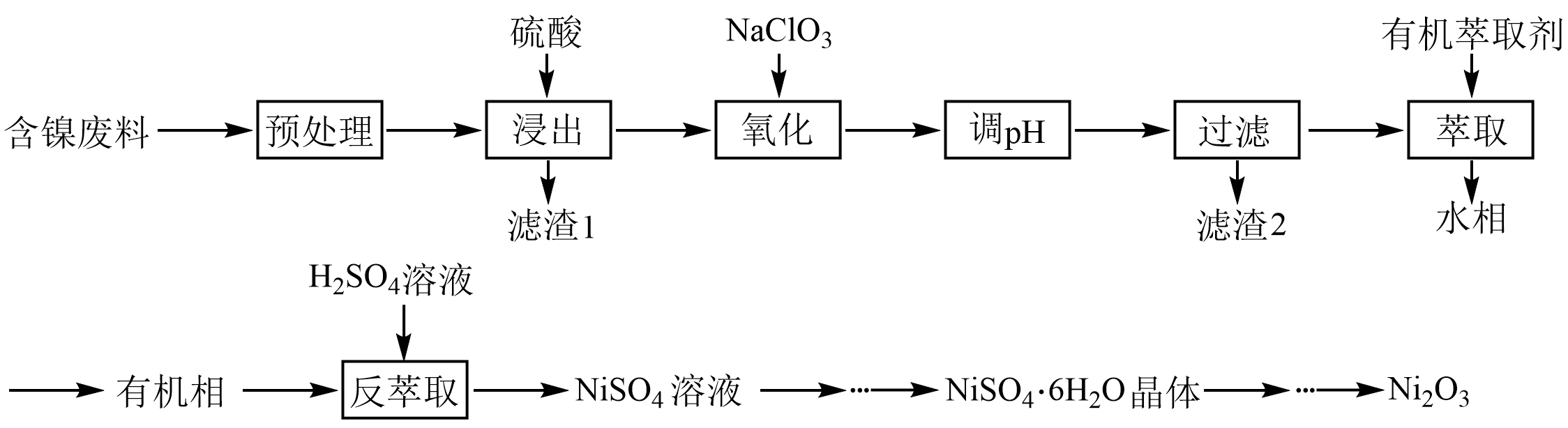
已知:①在该实验条件下$\text{NaCl}{{\text{O}}_{\text{3}}}$、$\text{Fe(III)}$不能氧化$\text{Ni(II)}$。
②常温下,溶液中$\text{0}\text{.010 mol}\cdot {{\text{L}}^{\text{-1}}}$金属离子形成氢氧化物沉淀的$\text{pH}$如下表所示:
| 离子$\rm \text{pH}$ | $\text{N}{{\text{i}}^{\text{2+}}}$ | $\text{A}{{\text{l}}^{\text{3+}}}$ | $\text{F}{{\text{e}}^{\text{3+}}}$ | $\text{F}{{\text{e}}^{\text{2+}}}$ |
| 开始沉淀$\text{pH}$ | $\rm 7.2$ | $\rm 3.7$ | $\rm 2.2$ | $\rm 7.5$ |
| 完全沉淀$\text{pH}$ | $\rm 8.7$ | $\rm -$ | $\rm 3.2$ | $\rm 9.0$ |
③萃取的原理为$\text{N}{{\text{i}}^{\text{2+}}}_{\text{(水相}\text{)}}\text{+2H}{{\text{R}}_{\text{(有机相}\text{)}}}\rightleftharpoons \text{Ni}{{\text{R}}_{\text{2}}}_{\text{(有机相}\text{)}}\text{+2}{{\text{H}}^{+}}_{\text{(水相}\text{)}}$。
回答下列问题:
“预处理时,可以用 $\rm ($填化学式$\rm )$溶液除去废料表面的油脂油污。
$\\text{N}{{\\text{a}}_{\\text{2}}}\\text{C}{{\\text{O}}_{\\text{3}}}$
"]]油脂油污属于酯类,在碱性条件下可以完全水解而被除去,因此在预处理含镍废料时可以用热的$\rm Na_{2}CO_{3}$溶液进行碱浸;
“浸出时,提高浸出效率可采取的措施有 $\rm ($任写一种$\rm )$。滤渣$\rm 1$的主要成分是 。
适当升高温度$\\rm ($将含镍废料粉碎,适当增大硫酸浓度等$\\rm )$ ; $\\rm SiO_{2}$、$\\rm C$
"]]提高浸出效率主要从加快反应速率、使反应更充分等角度考虑,因此可采取的措施有适当升高温度、将含镍废料粉碎,适当增大硫酸浓度等;含镍废料中不溶于稀硫酸的物质主要有$\rm SiO_{2}$、$\rm C$,因此酸浸完成后过滤得到的滤渣$\rm 1$主要成分是$\rm SiO_{2}$、$\rm C$;
“氧化时,加入$\text{NaCl}{{\text{O}}_{\text{3}}}$发生反应的离子方程式为 ,目的是 。
$\\rm 6Fe^{2+}+ClO_{3}^{-}+6H^{+}=6Fe^{3+}+Cl^{-}+3H_{2}O$ ; 将$\\rm \\text{F}{{\\text{e}}^{\\text{2+}}}$氧化为$\\rm \\text{F}{{\\text{e}}^{\\text{3+}}}$,便于后续通过调$\\rm \\text{pH}$除去
"]]$\rm NaClO_{3}$具有氧化性,能把$\rm Fe^{2+}$氧化成$\rm Fe^{3+}$,反应的离子方程式为:$\rm 6Fe^{2+}+ClO_{3}^{-}+6H^{+}=6Fe^{3+}+Cl^{-}+3H_{2}O$;因为$\rm \text{F}{{\text{e}}^{2+}}$与$\rm \text{N}{{\text{i}}^{2+}}$生成氢氧化物沉淀的$\rm pH$接近,如调$\rm pH$除去$\rm \text{F}{{\text{e}}^{2+}}$,会使$\rm \text{N}{{\text{i}}^{2+}}$损失,因此需要把$\rm \text{F}{{\text{e}}^{2+}}$氧化成$\rm \text{F}{{\text{e}}^{\text{3+}}}$后再除去,避免$\rm \text{N}{{\text{i}}^{2+}}$损失;
若常温下,“调$\text{pH}$时,溶液中$\text{N}{{\text{i}}^{\text{2+}}}$浓度为$\text{0}\text{.1 mol}\cdot {{\text{L}}^{\text{-1}}}$,为使$\text{A}{{\text{l}}^{\text{3+}}}$等杂质离子沉淀完全$\rm (\le \text{1}{{\text{0}}^{\text{-5}}}\text{ mol}\cdot {{\text{L}}^{\text{-1}}}\rm )$,经过计算,需控制溶液的$\text{pH}$范围是 。
$\\rm 4.7$~$\\rm 6.7($或$\\text{4}\\text{.7}\\le \\text{pH}\\lt \\text{6}\\text{.7}\\rm )$
"]]常温下,根据$\text{Ni(OH}{{\text{)}}_{\text{2}}}\text{(s)}\rightleftharpoons \text{N}{{\text{i}}^{\text{2+}}}\text{(aq)+2O}{{\text{H}}^{-}}\text{(aq)}$,结合表格数据得$\text{N}{{\text{i}}^{2+}}$开始沉淀时$c\text{(O}{{\text{H}}^{-}}\text{)=1}{{\text{0}}^{-6.8}}\text{ mol}\cdot {{\text{L}}^{-1}}$,则${{K}_{\text{sp}}}[\!\!\text{ Ni(OH}{{\text{)}}_{\text{2}}}]\!\!\text{ =}c\text{(N}{{\text{i}}^{\text{2+}}}\text{)}\times {{c}^{2}}\text{(O}{{\text{H}}^{-}}\text{)=0}\text{.010}\times \text{1}{{\text{0}}^{-6.8\times 2}}={{10}^{-15.6}}$,当溶液中$\text{N}{{\text{i}}^{2+}}$浓度为$0.1\text{ mol}\cdot {{\text{L}}^{-1}}$时,根据${{K}_{\text{sp}}}[\!\!\text{ Ni(OH}{{\text{)}}_{\text{2}}}]$计算得$c\text{(O}{{\text{H}}^{-}}\text{)=1}{{\text{0}}^{-7.3}}\text{ mol}\cdot {{\text{L}}^{-1}}$,此时$c\text{(}{{\text{H}}^{+}}\text{)=1}{{\text{0}}^{-6.7}}\text{ mol}\cdot {{\text{L}}^{-1}}$,为防止$\text{N}{{\text{i}}^{2+}}$损失,溶液$\rm pH$应小于$\rm 6.7$。同理可计得$\text{A}{{\text{l}}^{\text{3+}}}$完全沉淀时溶液$\rm pH=4.7$,故为使$\text{A}{{\text{l}}^{3+}}$等杂质离子沉淀完全,$\rm pH$应大于等于$\rm 4.7$。因此需要控制溶液的$\rm pH$范围是$\text{4}\text{.7}\le \text{pH}\lt \text{6}\text{.7}$或$\rm 4.7$~$\rm 6.7$;
“萃取时,操作若在实验室进行,需要用到的主要玻璃仪器有 、烧杯。请利用化学平衡原理解释该流程中用${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$反萃取的原理 。
分液漏斗 ; 体系中存在化学平衡:$\\text{N}{{\\text{i}}^{\\text{2+}}}_{\\text{(水相}\\text{)}}\\text{+2H}{{\\text{R}}_{\\text{(有机相}\\text{)}}}\\rightleftharpoons \\text{Ni}{{\\text{R}}_{\\text{2}}}_{\\text{(有机相}\\text{)}}\\text{+2}{{\\text{H}}^{+}}_{\\text{(水相}\\text{)}}$,向体系中加入足量${{\\text{H}}_{\\text{2}}}\\text{S}{{\\text{O}}_{\\text{4}}}$溶液,体系中${{\\text{H}}^{+}}$浓度增大,平衡体系逆向移动,镍元素由有机相$\\text{Ni}{{\\text{R}}_{\\text{2}}}$转变为水相中$\\text{NiS}{{\\text{O}}_{\\text{4}}}$,实现反萃取
"]]实验室进行萃取实验时,需要用到的主要玻璃仪器为分液漏斗、烧杯;该流程中用${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$反萃取的原理是:体系中存在化学平衡:$\text{N}{{\text{i}}^{\text{2+}}}_{\text{(水相}\text{)}}\text{+2H}{{\text{R}}_{\text{(有机相}\text{)}}}\rightleftharpoons \text{Ni}{{\text{R}}_{\text{2}}}_{\text{(有机相}\text{)}}\text{+2}{{\text{H}}^{+}}_{\text{(水相}\text{)}}$,向体系中加入足量${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$溶液,体系中${{\text{H}}^{+}}$浓度增大,平衡体系逆向移动,镍元素由有机相$\text{Ni}{{\text{R}}_{\text{2}}}$转变为水相中$\text{NiS}{{\text{O}}_{\text{4}}}$,实现反萃取;
资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
| 温度 | 低于$\text{30}\mathrm{}\text{8}\mathrm{}$ | $\text{30}\mathrm{}\text{8}\sim \text{53}\mathrm{}\text{8 }{}^\circ \text{C}$ | $\text{53}\mathrm{}\text{8}\sim \text{280}\mathrm{}$ | 高于$\text{280 }\mathrm{}$ |
| 晶体形态 | $\text{NiS}{{\text{O}}_{\text{4}}}\cdot \text{7}{{\text{H}}_{\text{2}}}\text{O}$ | $\text{NiS}{{\text{O}}_{\text{4}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$ | 多种结晶水合物 | $\text{NiS}{{\text{O}}_{\text{4}}}$ |
从$\text{NiS}{{\text{O}}_{\text{4}}}$溶液获得稳定的$\text{NiS}{{\text{O}}_{\text{4}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$晶体的操作是: 。
蒸发浓缩,冷却至$\\text{30}\\mathrm{}\\text{8}\\sim \\text{53}\\mathrm{}\\text{8 }{}^\\circ \\text{C}$之间结晶,过滤、洗涤、干燥得到$\\text{NiS}{{\\text{O}}_{\\text{4}}}\\cdot \\text{6}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]根据表格数据,由$\text{NiS}{{\text{O}}_{\text{4}}}$溶液获得稳定的$\text{NiS}{{\text{O}}_{\text{4}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$晶体的操作是:蒸发浓缩,冷却至$\text{30}\mathrm{}\text{8}\sim \text{53}\mathrm{}\text{8 }{}^\circ \text{C}$之间结晶,过滤、洗涤、干燥得到$\text{NiS}{{\text{O}}_{\text{4}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$。
| 盐类水解在生活中的应用题目答案及解析(完整版)
