| 杂化轨道理论 题目答案及解析
稿件来源:高途
| 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
镓$\rm (\text{Ga}\rm )$是非常重要的稀土金属,其化合物广泛应用于诸多领域。
镓元素在元素周期表中的位置是 。
第四周期第$\\rm IIIA$族
"]]镓元素在元素周期表中的位置是第四周期第$\rm IIIA$族;
工业上利用炼锌矿渣$\rm [$主要含可溶性铁酸镓$\text{G}{{\text{a}}_{2}}{{\left( \text{F}{{\text{e}}_{2}}{{\text{O}}_{4}} \right)}_{3}}$、铁酸锌$\mathrm{ZnFe}_2 \mathrm{O}_4\rm ]$提取$\text{Ga}$。矿渣经“酸浸”后所得酸浸液含有$\text{Z}{{\text{n}}^{2+}}$、$\text{F}{{\text{e}}^{3+}}$、$\text{G}{{\text{a}}^{3+}}$等离子,经萃取富集其中的镓元素用于后续反应可制备氮化镓晶体。萃取工艺流程如下图所示。
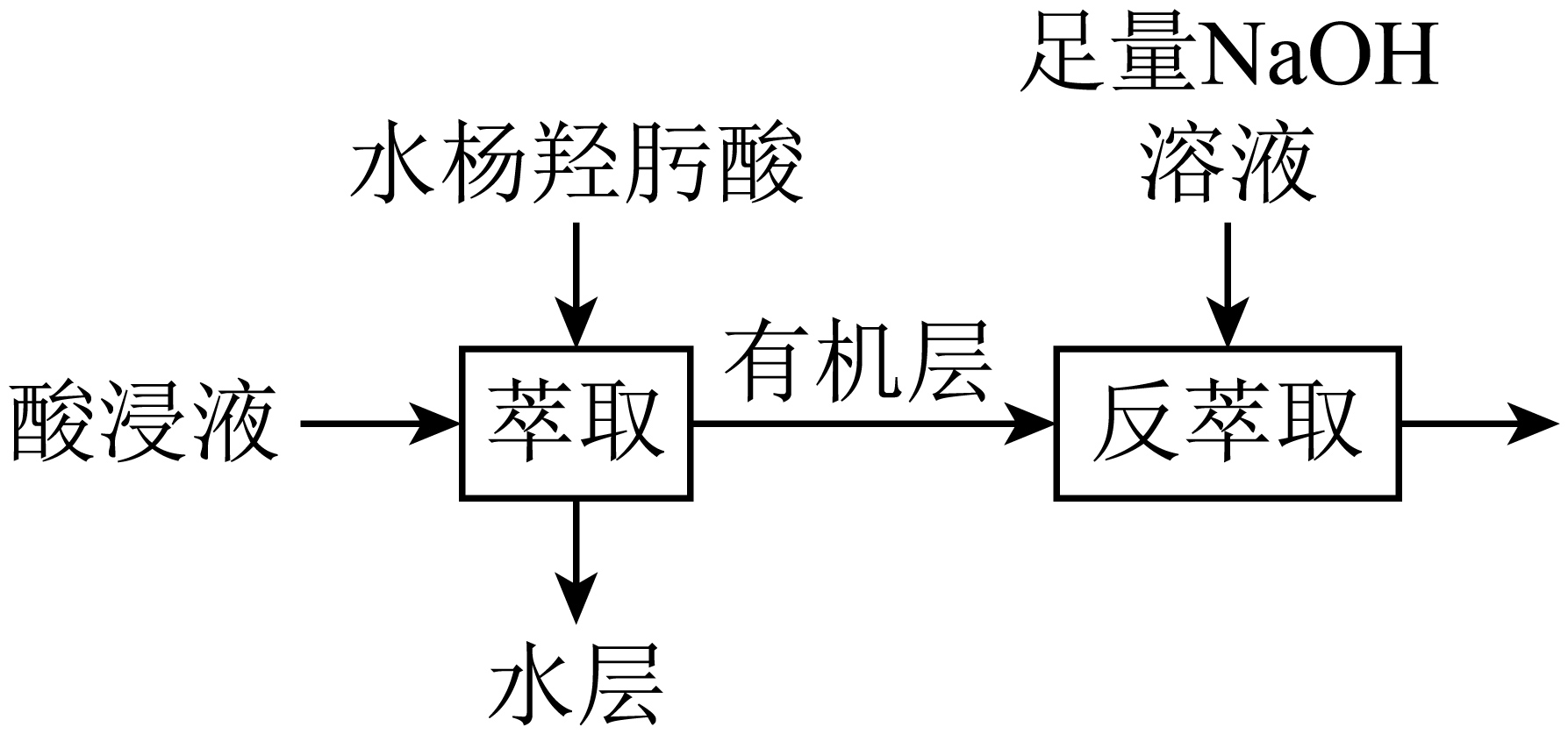
已知:金属离子在该工艺条件下的萃取率$\rm ($进入有机层中的金属离子百分数$\rm )$。
| 金属离子 | $\text{Z}{{\text{n}}^{2+}}$ | $\text{F}{{\text{e}}^{2+}}$ | $\text{F}{{\text{e}}^{3+}}$ | $\text{G}{{\text{a}}^{3+}}$ |
| 萃取率$\rm /\%$ | $\rm 0$ | $\rm 0$ | $\rm 99$ | $\rm 97\sim 98.5$ |
①“酸浸”过程中$\text{G}{{\text{a}}_{2}}{{\left( \text{F}{{\text{e}}_{2}}{{\text{O}}_{4}} \right)}_{3}}$发生的反应的离子方程式为 。
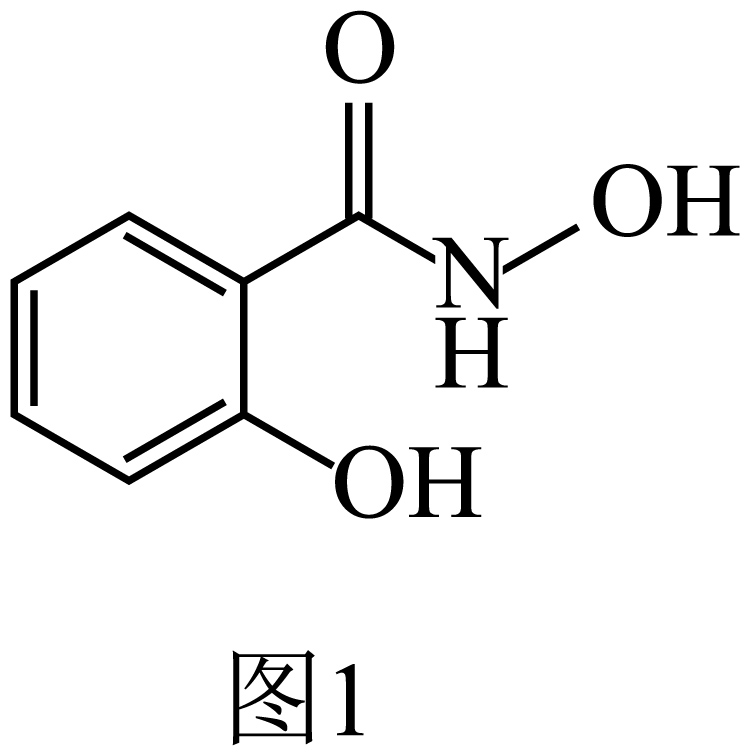
②萃取剂水杨羟肟酸的结构简式如图$\rm 1$所示,萃取时分子中的$\text{N}$、$\mathrm{O}$原子能与金属离子形成稳定的配位键。解释$\text{N}$、$\mathrm{O}$原子能作为配位原子的原因 。
③利用上述工艺,酸浸后的酸浸液应加入固体 $\rm ($填试剂$\rm )$充分反应后再进行萃取。
④“反萃取”后,溶液中镓元素的存在形式为 。$\rm ($填离子符号$\rm )$
$\\text{G}{{\\text{a}}_{\\text{2}}}{{\\left( \\text{F}{{\\text{e}}_{\\text{2}}}{{\\text{O}}_{\\text{4}}} \\right)}_{\\text{3}}}\\text{+24}{{\\text{H}}^{+}}\\text{=2G}{{\\text{a}}^{\\text{3+}}}\\text{+6F}{{\\text{e}}^{\\text{3+}}}\\text{+12}{{\\text{H}}_{\\text{2}}}\\text{O}$;能提供孤电子对;铁粉;$\\rm GaO_{2}^{-}$
"]]①矿渣经“酸浸”后所得酸浸液含有$\text{Z}{{\text{n}}^{2+}}$、$\text{F}{{\text{e}}^{3+}}$、$\text{G}{{\text{a}}^{3+}}$等离子,故“酸浸”过程中$\text{G}{{\text{a}}_{2}}{{\left( \text{F}{{\text{e}}_{2}}{{\text{O}}_{4}} \right)}_{3}}$发生的反应的离子方程式为:$\text{G}{{\text{a}}_{\text{2}}}{{\left( \text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}} \right)}_{\text{3}}}\text{+24}{{\text{H}}^{+}}\text{=2G}{{\text{a}}^{\text{3+}}}\text{+6F}{{\text{e}}^{\text{3+}}}\text{+12}{{\text{H}}_{\text{2}}}\text{O}$;②$\text{N}$、$\mathrm{O}$原子能作为配位原子的原因:能提供孤电子对;③萃取是为了$\rm Ga^{3+}$进入有机相,根据表格中数据,$\rm Fe^{3+}$的萃取率为$\rm 99$,$\rm Fe^{2+}$的萃取率为$\rm 0$,故萃取前应将$\rm Fe^{3+}$还原为$\rm Fe^{2+}$,加入的物质为铁粉;④$\rm Ga$与$\rm Al$同族,性质与铝相似,“反萃取”后,溶液中镓元素的存在形式为:$\rm GaO_{2}^{-}$;
氮化镓是非常重要的半导体材料,其立方晶胞如图$\rm 2$所示,与金刚石结构相似。
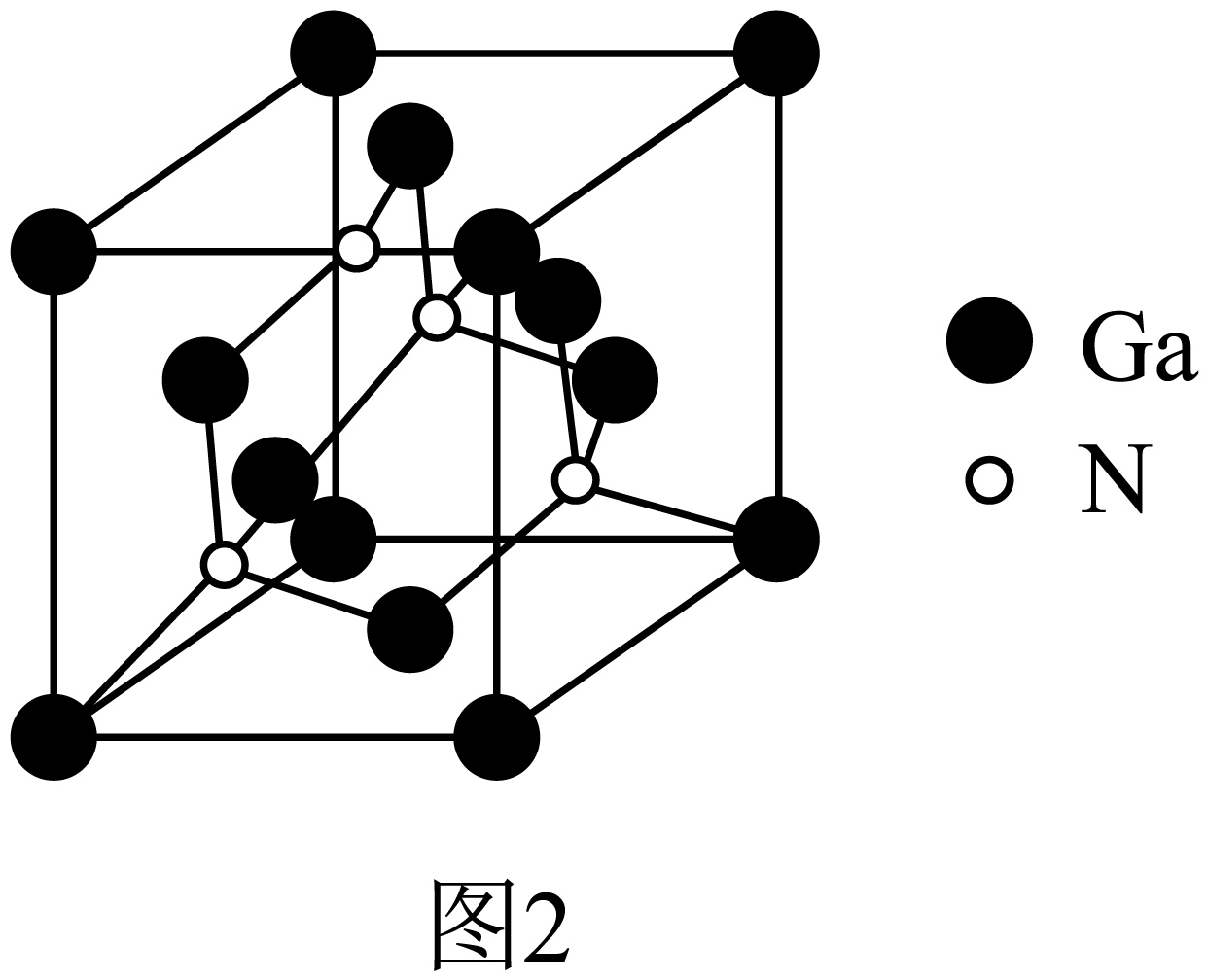
①$\text{Ga}$原子采用 杂化轨道成键。
②常压下,该晶体熔点为$1700\;{}^\circ \text{C}$,其晶体类型为 。
③已知$\text{GaN}$晶体中距离最近的$\text{Ga}$原子间的核间距为$ {a\;\rm pm}$,$\text{GaN}$的摩尔质量为$ {M\;\rm g}/\text{mol}$,阿伏加德罗常数的值为${{ {N}}_{\text{A}}}$,则$\text{GaN}$晶体的密度为 $\text{g}/\text{c}{{\text{m}}^{-3}}\left( 1\text{ pm}={{10}^{-12}}\;\rm \text{m} \right)$。
$\\rm sp^{3}$;共价晶体;$\\dfrac{\\sqrt{2} {M}}{{{N}_{\\text{A}}}{{ {a}}^{3}}}\\times \\text{1}{{\\text{0}}^{\\text{30}}}$
"]]①氮化镓与金刚石结构相似,$\text{Ga}$原子采用$\rm sp^{3}$杂化轨道成键;②该晶体熔点为$1700\;{}^\circ \text{C}$,晶体类型为:共价晶体;③根据均摊法,晶胞中$\rm N$原子个数为$\rm 4$,$\rm Ga$原子个数为:$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$,$\text{GaN}$晶体中距离最近的$\text{Ga}$原子间的核间距为$ {a\;\rm pm}$,故晶胞参数为:$\sqrt{2} {a\;\rm pm}=\sqrt{2} {a}\times \text{1}{{\text{0}}^{\text{-10}}}\text{ cm}$, $\text{GaN}$的摩尔质量为$ {M\;\rm g}/\text{mol}$,阿伏加德罗常数的值为${{ {N}}_{\text{A}}}$,则$\text{GaN}$晶体的密度为$ \rho=\dfrac{ {m}}{ {V}}=\dfrac{4\times \dfrac{ {M}}{{{N}_{\text{A}}}}}{{{(\sqrt{2} {a}\times \text{1}{{\text{0}}^{ {-10}}})}^{3}}}\text{ g/c}{{\text{m}}^{\text{3}}}=\dfrac{\sqrt{2} {M}}{{{N}_{\text{A}}}{{ {a}}^{3}}}\times \text{1}{{\text{0}}^{\text{30}}}\text{ g/c}{{\text{m}}^{\text{3}}}$。
| 杂化轨道理论题目答案及解析(完整版)
