高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
室温下,向新制酸化的和未酸化的$0.1\text{ mol}\cdot {{\text{L}}^{-1}}$的$\text{FeS}{{\text{O}}_{\text{4}}}$溶液中通入氧气且搅拌时,$\text{pH}$变化曲线如图。
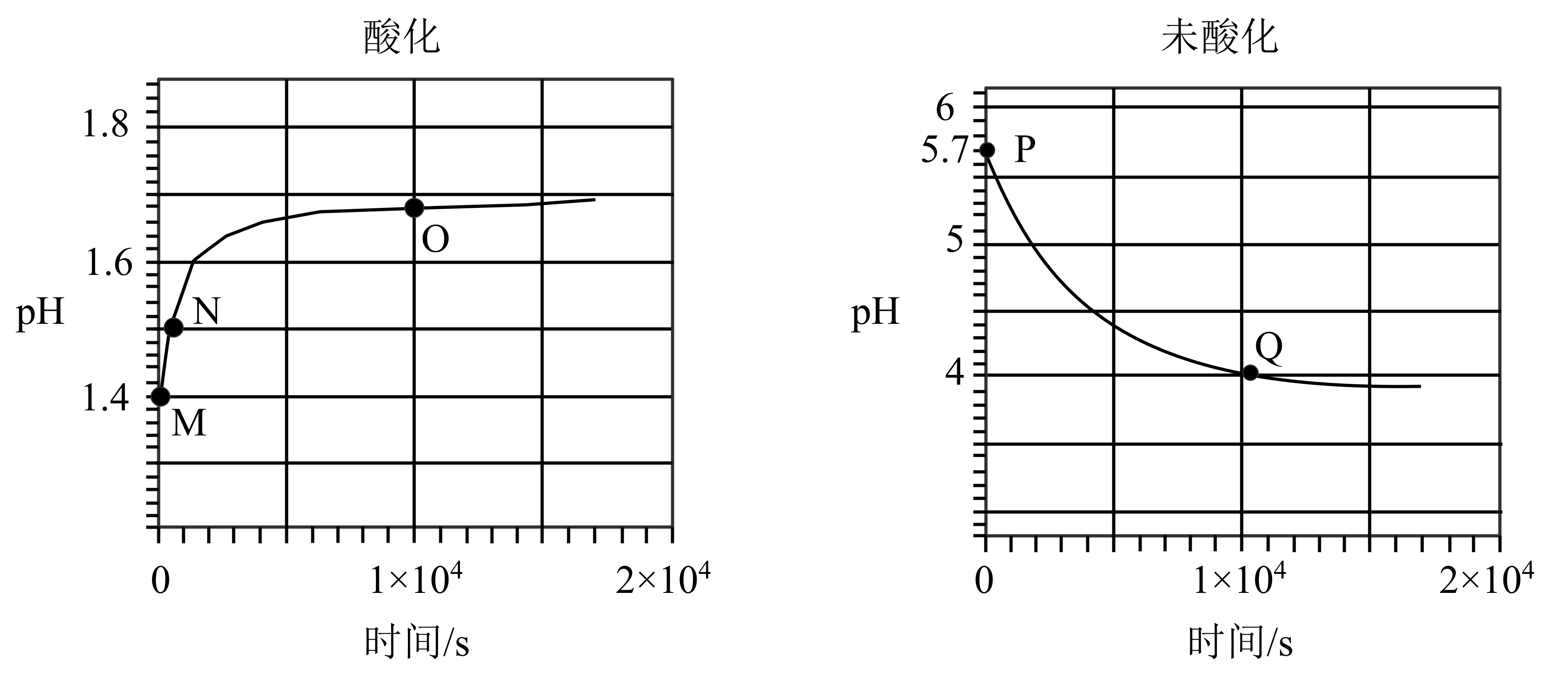
已知:$\rm Fe{{\left( OH \right)}_{3}}$的${{K}_{\text{sp}}}=2.8\times {{10}^{-39}}$;$\text{Fe}{{\left( \text{OH} \right)}_{2}}$的${{K}_{\text{sp}}}=4.9\times {{10}^{-17}}$
$\text{F}{{\text{e}}^{\text{3+}}}$开始沉淀时的$\text{pH}\approx 1.5$;$\text{F}{{\text{e}}^{\text{2+}}}$开始沉淀时的$\text{pH}\approx 6.3$
下列说法不正确的是$(\quad\ \ \ \ )$
$\\rm M$点对应的溶液中$\\text{F}{{\\text{e}}^{\\text{2+}}}$水解程度小于Р点对应的溶液中$\\text{F}{{\\text{e}}^{\\text{2+}}}$水解程度
","导致$\\rm M$点$\\rm →N$点$\\text{pH}$升高的反应为:$\\text{4F}{{\\text{e}}^{2+}}+{{\\text{O}}_{2}}+\\text{4}{{\\text{H}}^{+}}=4\\text{F}{{\\text{e}}^{3+}}+2{{\\text{H}}_{\\text{2}}}\\text{O}$
","导致Р点$\\rm →Q$点$\\text{pH}$降低的反应为:$\\text{4F}{{\\text{e}}^{2+}}+{{\\text{O}}_{2}}+\\text{10}{{\\text{H}}_{2}}\\text{O}=4\\text{Fe}{{\\left( \\text{OH} \\right)}_{3}}+8{{\\text{H}}^{+}}$
","$\\rm O$点和$\\rm Q$点后$\\text{pH}$变化不大,推测两个反应体系中一定不再发生$\\text{F}{{\\text{e}}^{\\text{2+}}}$的氧化反应
"]$\rm A$.$\text{F}{{\text{e}}^{\text{2+}}}$水解$\text{F}{{\text{e}}^{\text{2+}}}+{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{Fe}{{\left( \text{OH} \right)}_{2}}+2{{\text{H}}^{+}}$,增大$\rm H^{+}$浓度,抑制$\text{F}{{\text{e}}^{\text{2+}}}$水解,所以$\rm M$点对应的溶液中$\text{F}{{\text{e}}^{\text{2+}}}$水解程度小于Р点对应的溶液中$\text{F}{{\text{e}}^{\text{2+}}}$水解程度,$\rm A$正确;
$\rm B$.由图可知通氧气,$\rm PH\lt 1.5$时,$\text{F}{{\text{e}}^{\text{2+}}}$被氧气氧化,$\rm Fe^{3+}$不会形成氢氧化铁沉淀,所以 $\rm M$点$\rm →N$点$\text{pH}$升高,离子方程式$\text{4F}{{\text{e}}^{2+}}+{{\text{O}}_{2}}+\text{4}{{\text{H}}^{+}}=4\text{F}{{\text{e}}^{3+}}+2{{\text{H}}_{\text{2}}}\text{O}$,$\rm B$正确;
$\rm C$.由信息可知,未酸化的$\rm FeSO_{4}$,$\text{F}{{\text{e}}^{\text{2+}}}$被氧气氧化,$\rm Fe^{3+}$形成氢氧化铁沉淀,所以Р点$\rm →Q$点$\text{pH}$降低的反应为:$\text{4F}{{\text{e}}^{2+}}+{{\text{O}}_{2}}+\text{10}{{\text{H}}_{2}}\text{O}=4\text{Fe}{{\left( \text{OH} \right)}_{3}}+8{{\text{H}}^{+}}$,$\rm C$正确;
$\rm D$.$\rm O$点和$\rm Q$点后$\text{pH}$变化不大,可能是两个反应体系中$\text{F}{{\text{e}}^{\text{2+}}}$氧化反应的速率减慢,$\rm D$错误;
故选:$\rm D$
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
