高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲醇是一种重要的基础化工原料,也是一种很有前景的燃料。利用工业废气中的$\rm CO_{2}$、$\rm CO$与$\rm H_{2}$反应都可以制得甲醇。某温度下,在一恒容密闭容器中进行反应: $\text{CO}\left( \text{g} \right)+\text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)\quad \Delta H=-90.14\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
该反应平衡常数的表达式为 。
$K=\\dfrac{c(\\text{C}{{\\text{H}}_{\\text{3}}}\\text{OH)}}{c(\\text{CO}){{c}^{2}}({{\\text{H}}_{\\text{2}}})}$
"]]该反应平衡常数的表达式为$K=\dfrac{c(\text{C}{{\text{H}}_{\text{3}}}\text{OH)}}{c(\text{CO}){{c}^{2}}({{\text{H}}_{\text{2}}})}$;
若压强、投料比对$x[\dfrac{n(\text{CO})}{n({{\text{H}}_{2}})}]$的百分含量的影响如图所示。则图中曲线所示的压强关系:${{p}_{1}}$ ${{p}_{2}}$。
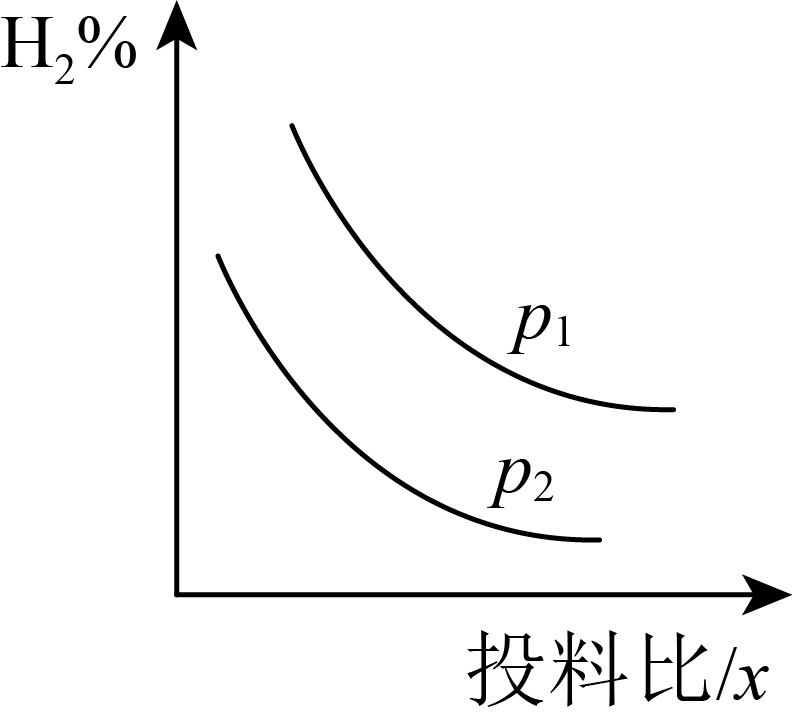
$\rm A$.$\rm \gt $ $\rm B$.$\rm \lt $ $\rm C$.$\rm =$ $\rm D$.无法确定
$\\rm B$
"]]该反应是气体分子数减小的反应,增大压强,平衡正移,氢气百分含量减小,所以${{p}_{1}}\lt {{p}_{2}}$;
若反应各物质起始浓度分别为$c\left( \text{CO} \right)=1.0\,\text{mol/L}$,$c\left( {{\text{H}}_{\text{2}}} \right)=2.4\,\text{mol/L}$,$\rm 5$ $\rm min$后达到平衡,$\rm [CO]=0.5$ $\rm mol·L^{-l}$,则$\rm 5$ $\rm min$内$\rm H_{2}$的平均反应速率为 。
$\\rm 0.2$ $\\rm mol·L^{-1}·min^{-1}$
"]]$\begin{matrix} {} & \text{CO(g)} & + & \text{2}{{\text{H}}_{\text{2}}}\text{(g)} & \rightleftharpoons & \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)} \\开始 \text{mol }\!\!\cdot{{\text{L}}^{\text{-l}}} & \text{1} & {} & \text{2}\text{.4} & {} & \text{0} \\ 转化\text{mol }\!\!\cdot{{\text{L}}^{\text{-l}}} & \text{0}\text{.5} & {} & \text{1} & {} & \text{0}\text{.5} \\ 平衡\text{mol }\!\!\cdot{{\text{L}}^{\text{-l}}} & \text{0}\text{.5} & {} & \text{1}\text{.4} & {} & \text{0}\text{.5} \\ \end{matrix}$,则$\rm 5$ $\rm min$内$\rm H_{2}$的平均反应速率为$\dfrac{\text{1}}{\text{5}}\,\text{mol}\cdot {{\text{L}}^{\text{-1}}}\cdot \text{mi}{{\text{n}}^{\text{-1}}}\text{=0}\text{.2}\,\text{mol}\cdot {{\text{L}}^{\text{-1}}}\cdot \text{mi}{{\text{n}}^{\text{-1}}}$;
若反应物的起始浓度分别为$c\left( \text{CO} \right)=4.0\,\text{mol/L}$,$c\left( {{\text{H}}_{\text{2}}} \right)=a\,\text{mol/L}$,达平衡后$\rm [CH_{3}OH]=2.0$ $\rm mol·L^{-l}$,$a=$ 。
$\\rm 5.4$
"]]$\begin{matrix} {} & \text{CO(g)} & + & \text{2}{{\text{H}}_{\text{2}}}\text{(g)} & \rightleftharpoons & \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)} \\开始 \text{mol }\!\!\cdot{{\text{L}}^{\text{-l}}} & \text{4} & {} & a & {} & \text{0} \\转化 \text{mol }\!\!\cdot{{\text{L}}^{\text{-l}}} & \text{2} & {} & \text{4} & {} & \text{2} \\平衡 \text{mol }\!\!\cdot{{\text{L}}^{\text{-l}}} & \text{2} & {} & a-4 & {} & \text{2} \\ \end{matrix}$,根据第$\rm 3$问知,平衡常数$K=\dfrac{c(\text{C}{{\text{H}}_{\text{3}}}\text{OH})}{c(\text{CO}){{c}^{2}}({{\text{H}}_{2}})}=\dfrac{0.5}{{{1.4}^{2}}\times 0.5}=\dfrac{1}{{{1.4}^{2}}}$,则$K=\dfrac{c(\text{C}{{\text{H}}_{\text{3}}}\text{OH})}{c(\text{CO}){{c}^{2}}({{\text{H}}_{2}})}=\dfrac{2}{{{(a-4)}^{2}}\times 2}=\dfrac{1}{{{1.4}^{2}}}$,${a}=5.4$;
下列能说明该反应达到平衡状态的是
$\rm A$.容器内气体压强不再改变
$\rm B$.容器内气体密度不再改变
$\rm C$.$c\left( {{\text{H}}_{\text{2}}} \right)$与$c\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)$的比值保持不变
$\rm D$.单位时间内有$\rm 2$ $\rm mol$ $\rm H_{2}$消耗的同时有$\rm 1$ $\rm mol\ CH_{3}OH$生成
$\\rm AC$
"]]$\rm A$. 该反应是气体分子数减小的反应,容器内气体压强是变量,因此压强不变时达平衡,正确; $\rm B$. 容器内混合气体的质量与体积一直不变,所以密度一直不变,因此不一定达平衡,错误; $\rm C$. 当$c\left( {{\text{H}}_{\text{2}}} \right)$与$c\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)$的比值保持不变时,即各物质的浓度不再变化,则一定达平衡,正确; $\rm D$.单位时间内有$\rm 2$ $\rm mol$ $\rm H_{2}$消耗的同时一定有$\rm 1$ $\rm mol$ $\rm CH_{3}OH$生成,因此不一定达平衡,错误;
利用$\rm CO_{2}$和$\rm H_{2}$的混合气在催化剂$\rm M$存在的条件下制甲醇的催化过程如图所示,反应物、产物均为气态物质。若生成$\rm 1$ $\rm mol$ $\rm CH_{3}OH$放出热量$\rm 48.97$ $\rm kJ$。写出其反应的热化学方程式: 。
$\\text{C}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)+\\text{3}{{\\text{H}}_{\\text{2}}}\\left( \\text{g} \\right)\\rightleftharpoons \\text{C}{{\\text{H}}_{\\text{3}}}\\text{OH}\\left( \\text{g} \\right)+{{\\text{H}}_{\\text{2}}}\\text{O}\\left( \\text{g} \\right)\\quad \\Delta H=48.97\\,\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$
"]]根据信息可知:$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{3}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H=48.97\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
生成$\rm CH_{3}OH$的同时,还存在副反应: $\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$,其$\Delta H=$ $\rm \;\rm kJ·mol^{-l}$,则从化学反应的自发性角度分析,温度应控制在 $\rm ($填“高温”或“低温”$\rm )$下才有利于主反应进行。
$\\rm +41.17$ ; 低温
"]]①$\text{CO}\left( \text{g} \right)+2{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)\quad \Delta H=-90.14\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,②$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{3}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H=48.97\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,根据盖斯定律,②$\rm -$①得,$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$,$\Delta H=48.97\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}+90.14\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=+41.17\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,当$\Delta H-T\Delta S\lt 0$时,反应可以自发进行,主反应$\Delta S\lt 0$,则低温下才有利于主反应进行。
高中 | 化学平衡常数题目答案及解析(完整版)
