高中 | 导电的原因及条件 题目答案及解析
稿件来源:高途
高中 | 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
半导体极大地丰富了人们的生活,在众多领域发挥重要作用。第三代半导体材料$\rm AlN$、$\rm GaN$成键结构与金刚石相似,晶体中只存在$\rm N-Al$键、$\rm N-Ga$键。
基态$\rm Ga$原子的价层电子排布式为 。
$\\text{4}{{\\text{s}}^{\\text{2}}}\\text{4}{{\\text{p}}^{\\text{1}}}$
"]]$\rm Ga$的原子序数为$\rm 31$,核外电子数为$\rm 31$,基态原子电子排布式为:$\text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{6}}}\text{3}{{\text{s}}^{\text{2}}}\text{3}{{\text{p}}^{\text{6}}}\text{3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{2}}}\text{4}{{\text{p}}^{\text{1}}}$,则价层电子排布式为$\text{4}{{\text{s}}^{\text{2}}}\text{4}{{\text{p}}^{\text{1}}}$;
$\rm AlN$与$\rm GaN$中,$\rm N$原子的杂化方式为 ,由此推测在两种晶体中,均存在配位键。以$\rm AlN$为例,说明$\rm Al$与$\rm N$原子间可形成配位键的原因: 。
$\\text{s}{{\\text{p}}^{3}}$;铝原子可以提供空轨道,氮原子提供孤电子对,所以$\\rm Al$与$\\rm N$原子间可以形成配位键
"]]金刚石中每个$\rm C$原子形成$\rm 4$个共价键,$\rm C$原子无孤电子对,$\rm C$原子的价层电子对数为$\rm 4$,$\rm C$原子均采取$\rm sp^{3}$杂化,由于$\rm AlN$、$\rm GaN$与金刚石结构相似,晶体中只存在$\rm N-Al$键、$\rm N-Ga$键,则$\rm N$原子的杂化方式为$\rm sp^{3}$;以$\rm AlN$为例,$\rm Al$与$\rm N$原子间可形成配位键的原因是:铝原子可以提供空轨道,氮原子提供孤电子对,故$\rm Al$与$\rm N$原子间可形成配位键;
硅是传统半导体材料,晶体硅与金刚石结构相似,但二者性质有所差异。解释金刚石硬度大于晶体硅的原因: 。
原子半径$\\rm C\\lt Si$,$\\text{C}-\\text{C}$键比$\\text{Si}-\\text{Si}$键键长短,键能大
"]]晶体硅与金刚石结构相似,二者都属于共价晶体,金刚石硬度大于晶体硅的原因是:原子半径$\rm C\lt Si$,$\text{C}-\text{C}$键比$\text{Si}-\text{Si}$键键长短,键能大,故金刚石硬度大于晶体硅;
以$\text{C}{{\text{u}}_{2}}\text{O}$、$\rm ZnO$等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。
$\rm Cu$、$\rm Zn$等金属能导电的原因是 。铜的焰色是绿色,产生此焰色时属于 $\rm ($填“发射”或“吸收”$\rm )$光谱。
金属结构中存在自由电子,自由电子在外加电场中作定向移动,故金属具有良好的导电性;发射
"]]$\rm Cu$、$\rm Zn$等金属能导电的原因是$\rm Cu$、$\rm Zn$等金属结构中存在自由电子,自由电子在外加电场中作定向移动,故金属具有良好的导电性;铜的焰色是绿色的可见光,光是电子跃迁释放能量的表现形式,故产生此焰色时属于发射光谱;
$\rm ZnO$晶体中部分氧原子被氮原子替代后可改善半导体性能。推断$\rm Zn$与$\rm N$之间、$\rm Zn$与$\rm O$之间,哪种更有可能形成离子键,并简述推测的依据: 。
$\\rm Zn$与$\\rm O$更有可能形成离子键,因为$\\rm O$的电负性大于$\\rm N$,$\\rm Zn$与$\\rm O$之间电负性的差值较大
"]]由于$\rm N$的电负性小于$\rm O$,$\rm Zn$与$\rm N$电负性的差值小于$\rm Zn$与$\rm O$电负性的差值,原子间电负性差值越大,形成离子键的可能性越大,故更有可能形成离子键的是$\rm Zn$与$\rm O$;故答案为:$\rm Zn$与$\rm O$更有可能形成离子键,因为$\rm O$的电负性大于$\rm N$,$\rm Zn$与$\rm O$之间电负性的差值较大;
$\text{C}{{\text{u}}_{2}}\text{O}$晶胞结构如图:
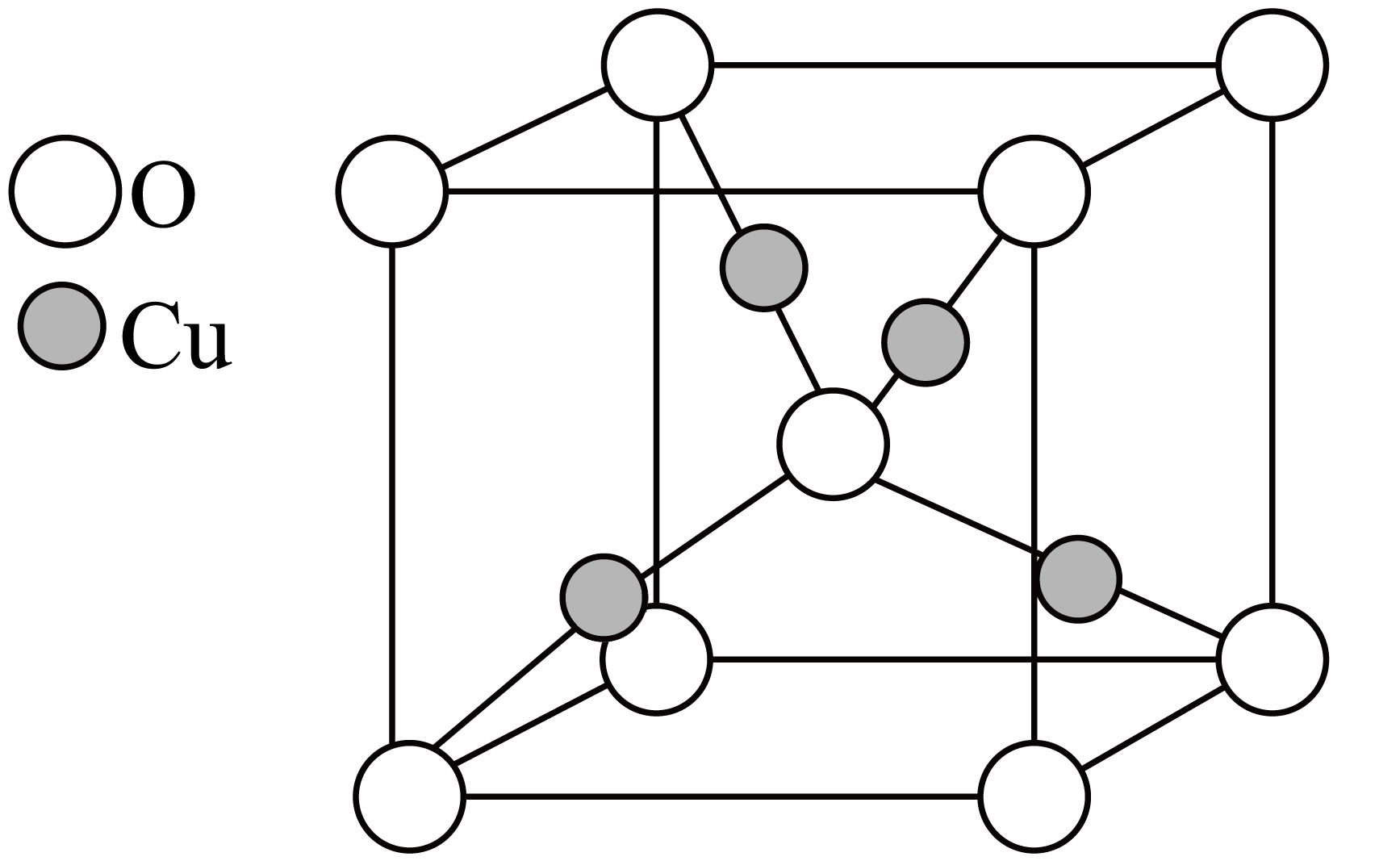
已知阿伏加德罗常数为${{ {N}}_{\text{A}}}$,最近的两个氧原子距离为$a\;\rm nm$,计算$\text{C}{{\text{u}}_{2}}\text{O}$晶体的密度为 $\text{g}\cdot \text{c}{{\text{m}}^{\text{-3}}}$。
$\\dfrac{\\sqrt{3}\\times 1.08\\times {{10}^{23}}}{{{ {a}}^{3}}\\cdot {{ {N}}_{\\text{A}}}}$
"]]$\rm Cu$原子位于晶胞体内有$\rm 4$个,$\rm O$原子位于晶胞顶角及体心有$8\times \dfrac{1}{8}+1=2$个,最近的两个氧原子为顶角与体心的两个$\rm O$原子,距离为$a\;\rm nm$,则晶胞参数边长为$\dfrac{2{a}}{\sqrt{3}}\;\rm{nm}$,根据$\rho =\dfrac{{n}\cdot {M}}{{V}\cdot {{{N}}_{\rm{A}}}}$计算,$\rho =\dfrac{2\times \left( 64\times 2+16 \right)}{{{\left( \dfrac{2{a}}{\sqrt{3}}\times {{10}^{-7}} \right)}^{3}}\cdot {{{N}}_{\rm{A}}}}{\;\rm{g}\cdot {c}{{{m}}^{{-3}}}}=\dfrac{\sqrt{3}\times 1.08\times {{10}^{23}}}{{{{a}}^{3}}\cdot {{{N}}_{\rm{A}}}}\rm\;{ g}\cdot {c}{{{m}}^{{-3}}}$。
高中 | 导电的原因及条件题目答案及解析(完整版)
