| 杂化轨道理论 题目答案及解析
稿件来源:高途
| 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
氟原子激发态的电子排布式有 ,其中能量较高的是 $\rm ($填标号$\rm )$。
$\rm a$.$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{4}}}\text{3}{{\text{s}}^{\text{1}}}$ $\rm b$.$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{4}}}\text{3}{{\text{d}}^{\text{2}}}$ $\rm c$.$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{1}}}\text{2}{{\text{p}}^{\text{5}}}$ $\rm d$.$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{3}}}\text{3}{{\text{p}}^{\text{2}}}$
$\\rm ad$;$\\rm d$
"]]基态$\rm F$原子电子排布式为$\rm 1s^{2}2s^{2}2p^{5}$。
$\rm a$.$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{4}}}\text{3}{{\text{s}}^{\text{1}}}$是基态$\rm F$原子$\rm 2p$能级$\rm 1$个电子激发到$\rm 3s$能级,故选:$\rm a$;
$\rm b$.$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{4}}}\text{3}{{\text{d}}^{\text{2}}}$有$\rm 10$个电子,不是$\rm F$原子的电子排布式,故不选$\rm b$;
$\rm c$.$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{1}}}\text{2}{{\text{p}}^{\text{5}}}$有$\rm 8$个电子,不是$\rm F$原子的电子排布式,故不选$\rm c$;
$\rm d$.$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{3}}}\text{3}{{\text{p}}^{\text{2}}}$是基态$\rm F$原子$\rm 2p$能级$\rm 2$个电子激发到$\rm 3p$能级,故选:$\rm d$;
选$\rm ad$;
$\rm 3p$能级的能量大于$\rm 3s$,所以能量较高的是$\rm \text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{3}}}\text{3}{{\text{p}}^{\text{2}}}$,选$\rm d$。
一氯乙烯$\rm ({{\text{C}}_{2}}{{\text{H}}_{3}}\text{Cl}\rm )$分子中,$\rm C$的一个 杂化轨道与$\text{Cl}$的$\text{3p}_x $轨道形成$\text{C-Cl}$ 键。
$\\mathrm{sp}^2$;$\\sigma$
"]]单键都是$\sigma $键,一氯乙烯$\rm ({{\text{C}}_{2}}{{\text{H}}_{3}}\text{Cl}\rm )$分子中,$\rm C$原子采用$\rm sp^{2}$杂化,$\rm C$的一个$\mathrm{sp}^2$杂化轨道与$\text{Cl}$的$\text{3p}_x $轨道形成$\rm{C-Cl} \sigma$键。
卤化物$\text{CsIC}{{\text{l}}_{2}}$受热发生非氧化还原反应,生成无色晶体$\rm X$和红棕色液体$\rm Y$。$\rm X$为 ,解释$\rm X$的熔点比$\rm Y$高的原因 。
$\\text{CsCl}$;$\\text{CsCl}$为离子晶体,$\\text{ICl}$为分子晶体
"]]卤化物$\text{CsIC}{{\text{l}}_{2}}$受热发生非氧化还原反应,可知元素化合价不变,所以生成无色晶体$\rm X$是$\rm CsCl$,红棕色液体$\rm Y$是$\rm ICl$;$\rm CsCl$是离子晶体、$\rm ICl$是分子晶体,所以$\rm CsCl$的熔点比$\rm ICl$高。
$\rm \alpha { -AgI}$晶体中$\rm \mathrm{I}^{-}$离子作体心立方堆积$\rm ($如图所示$\rm )$,$\rm \text{A}{{\text{g}}^{+}}$主要分布在由$\rm {{\text{I}}^{-}}$构成的四面体、八面体等空隙中。在电场作用下,$\rm \text{A}{{\text{g}}^{+}}$不需要克服太大的阻力即可发生迁移。因此,$\rm \alpha { -AgI}$晶体在电池中可作为 。
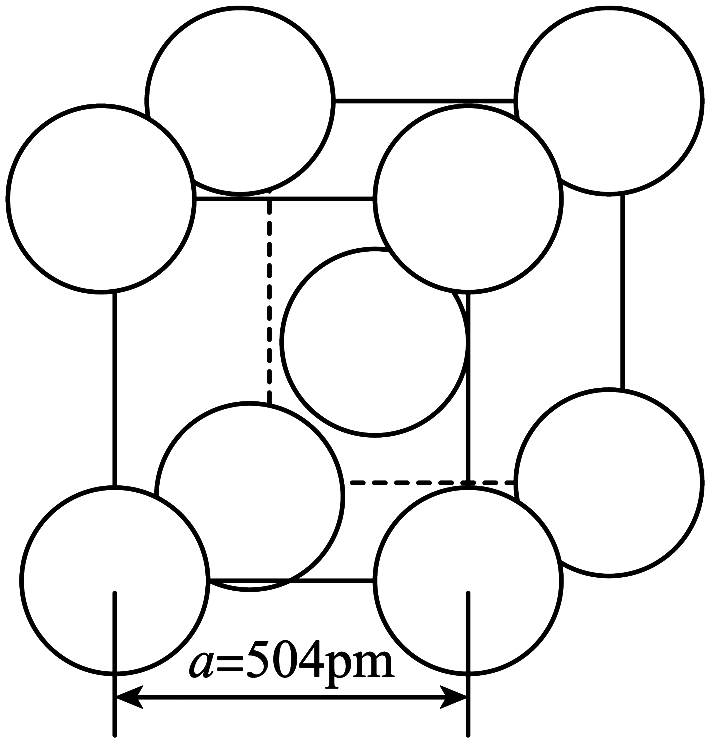
已知阿伏加德罗常数为${{ {N}}_{\text{A}}}$,则$\rm {\alpha-AgI}$晶体的摩尔体积${{ {V}}_{\text{m}}}=$ ${{\text{m}}^{3}}\cdot \text{mo}{{\text{l}}^{-1}}\rm ($列出算式$\rm )$。
电解质或离子导体;$\\dfrac{{{{N}}_{\\rm {A}}}\\times {{\\left( 504\\times {{10}^{-12}} \\right)}^{3}}}{2}$
"]]$\rm \alpha{ -AgI}$晶体中$\rm \mathrm{I}^{-}$离子作体心立方堆积$\rm ($如图所示$\rm )$,$\rm {A}{{{g}}^{+}}$主要分布在由$\rm {{{I}}^{-}}$构成的四面体、八面体等空隙中。在电场作用下,$\rm {A}{{{g}}^{+}}$不需要克服太大的阻力即可发生迁移,可知$\rm { }\alpha{ -AgI}$晶体可以导电,因此,$\rm { }\alpha{ -AgI}$晶体在电池中可作为离子导体或电解质。
晶胞的体积为$\rm {{\left( 504\times {{10}^{-12}} \right)}^{3}}\;{{{m}}^{3}}$,根据均摊原则,晶胞中$\rm I^{-}$数为$\rm 8\times \dfrac{1}{8}+1=2$,则$\rm 1\;\rm mol\;{\alpha-AgI}$中晶胞数为$\dfrac{{{N}_{\rm {A}}}}{2}$,$\rm 1\;\rm mol\;\alpha{ -AgI}$的体积为${{\left( 504\times {{10}^{-12}} \right)}^{3}}\;{{\rm {m}}^{3}}\times \dfrac{{{N}_{\rm {A}}}}{2}$,则$\rm \alpha{ -AgI}$晶体的摩尔体积${{{V}}_{\rm {m}}}=\dfrac{{{{N}}_{\rm {A}}}\times {{\left( 504\times {{10}^{-12}} \right)}^{3}}}{2}\rm \;{{{m}}^{3}}\cdot {mo}{{{l}}^{-1}}$。
将$\text{AgI}$晶体用液氨浸泡,$\text{AgI}$溶解。将此混合物溶于水中后,溶液呈无色,再滴入$\rm 3$滴乙醛,振荡后将试管放在热水浴中温热,一段时间后有银镜出现。试写出有关反应:
①$\rm \text{AgI}$晶体溶解液氨的离子方程式 。
②写出该过程中发生银镜反应的化学方程式 。
$\\rm {Agl+2N}{{{H}}_{{3}}}{=Ag(N}{{{H}}_{{3}}})_{{2}}^{+}+{{{I}}^{-}}$;$\\rm {C}{{{H}}_{{3}}}{CHO+2 }[{ Ag(N}{{{H}}_{{3}}}{{)}_{{2}}}]{ I+}{{{H}}_{2}}{O}\\begin{array}{*{20}{c}}{\\underline{\\underline {\\triangle}} }\\\\{}\\end{array} {C}{{{H}}_{{3}}}{COON}{{{H}}_{{4}}}{+2Ag}\\downarrow {+N}{{{H}}_{{3}}}{+2N}{{{H}}_{{4}}}{I}$
"]]将$\rm {AgI}$晶体用液氨浸泡,$\rm {AgI}$溶解。将此混合物溶于水中后,溶液呈无色,再滴入$\rm 3$滴乙醛,振荡后将试管放在热水浴中温热,一段时间后有银镜出现,可知$\rm {AgI}$晶体用液氨浸泡得到$\rm {{\left[ {Ag}{{\left( {N}{{{H}}_{{3}}} \right)}_{2}} \right]}^{+}}$和$\rm I^{-}$ 。
①$\rm {AgI}$晶体溶解液氨的离子方程式$\rm {Agl+2N}{{{H}}_{3}}{=Ag(N}{{{H}}_{{3}}})_{{2}}^{+}+{{{I}}^{-}}$。
②$\rm [{ Ag(N}{{{H}}_{{3}}}{{)}_{{2}}}]{ I}$和乙醛反应生成乙酸铵、银、氨气、$\rm NH_{4}I$,该过程中发生银镜反应的化学方程式$\rm {C}{{{H}}_{{3}}}{CHO+2 }[{ Ag(N}{{{H}}_{{3}}}{{)}_{{2}}}]{ I+}{{{H}}_{2}}{O}\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array} {C}{{{H}}_{{3}}}{COON}{{{H}}_{{4}}}{+2Ag}\downarrow {+N}{{{H}}_{{3}}}{+2N}{{{H}}_{{4}}}{I}$。
| 杂化轨道理论题目答案及解析(完整版)
