| 盐类水解在生活中的应用 题目答案及解析
稿件来源:高途
| 盐类水解在生活中的应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解在生活中的应用
下列实验选择的试剂和装置都正确且能达到实验目的的是$\rm (\qquad)$
| 实验装置 | 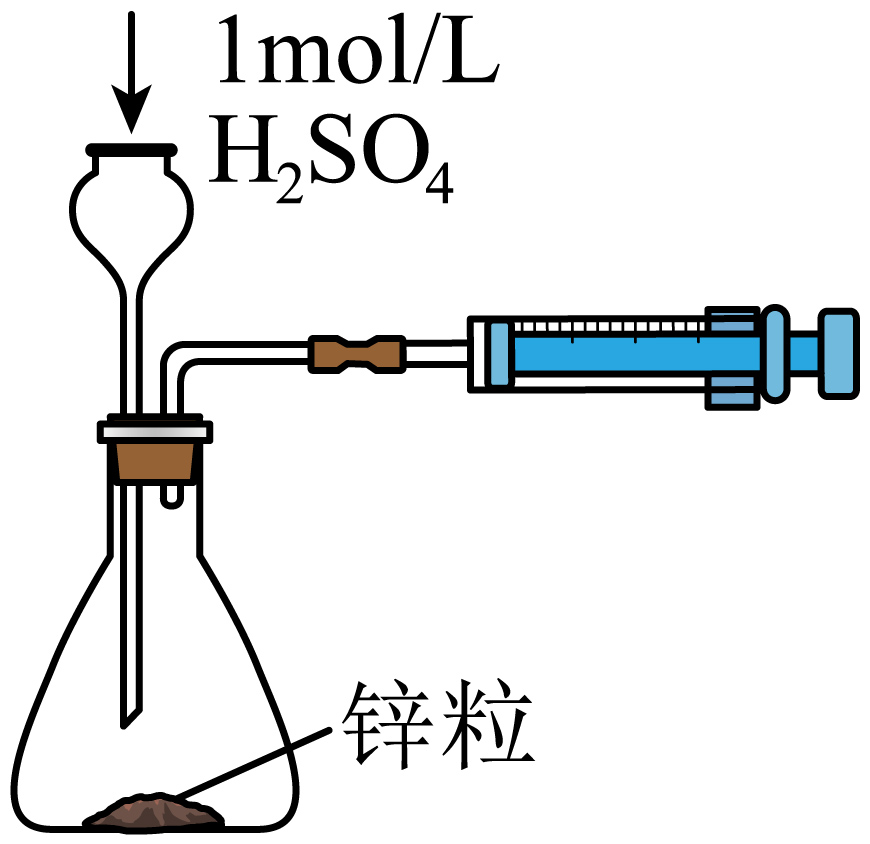 | 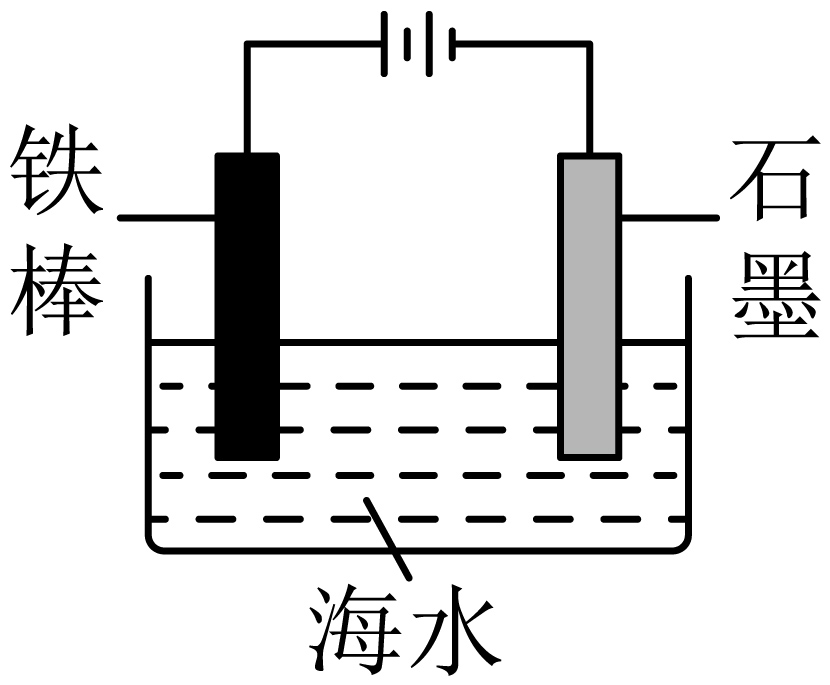 |
| 实验目的 | $\rm A$.测定生成氢气的反应速率 | $\rm B$.模拟外加电源法保护金属铁 |
| 实验装置 | 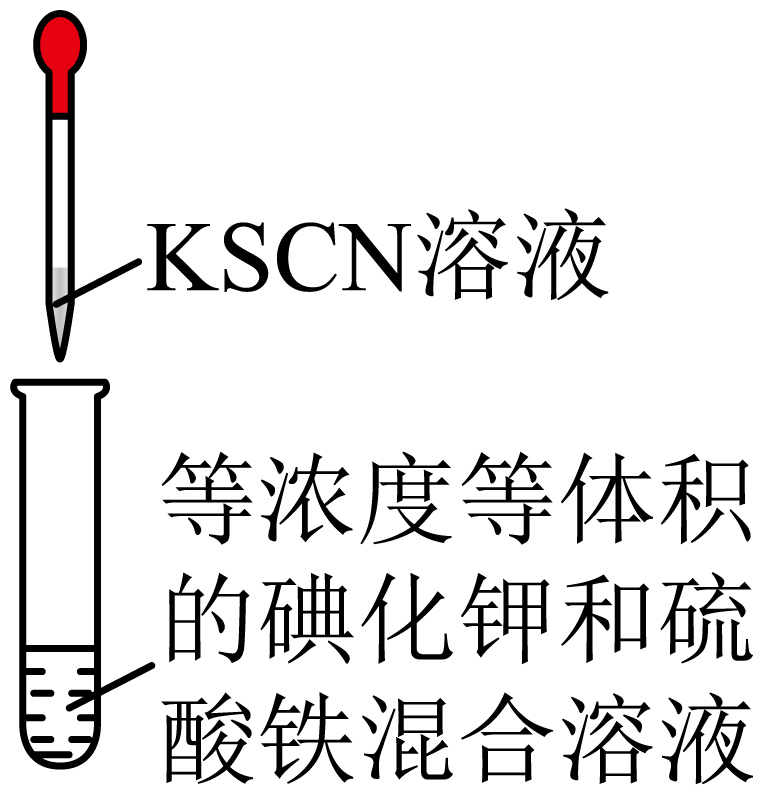 |  |
| 实验目的 | $\rm C$.验证$\rm Fe^{3+}$与$\rm I^{-}$的反应是可逆反应 | $\rm D$.蒸干硫酸铁溶液制取硫酸铁固体 |
$\\rm A$
","$\\rm B$
","$\\rm C$
","$\\rm D$
"]$\rm A$.测定生成氢气的反应速率时,为防止漏气,应使用分液漏斗,不能用长颈漏斗,$\rm A$错误;
$\rm B$.采用电解方法保护金属$\rm Fe$时,应将铁与外加电源的负极相连,$\rm Fe$电极作阴极,而不能将铁棒与外接电源的正极连接作阳极,$\rm B$错误;
$\rm C$.$\rm Fe^{3+}$与$\rm I^{-}$会发生反应:$\rm 2Fe^{3+}+2I^{-}=2Fe^{2+}+I_{2}$,二者反应时物质的量相等,因此等浓度等体积的$\rm KI$和$\rm Fe_{2}(SO_{4})_{3}$溶液混合时,$\rm Fe^{3+}$过量,溶液中过量的$\rm Fe^{3+}$会和$\rm KSCN$溶液反应生成红色$\rm Fe(SCN)_{3}$,因此反应后溶液一定变红色,无法判断该反应是否是可逆反应,$\rm C$错误;
$\rm D$.蒸干硫酸铁溶液的过程中,$\rm Fe^{3+}$水解产生$\rm Fe(OH)_{3}$,同时产生$\rm H_{2}SO_{4}$,因硫酸是难挥发性酸,故$\rm Fe(OH)_{3}$与$\rm H_{2}SO_{4}$会再反应产生$\rm Fe_{2}(SO_{4})_{3}$,因此最终可获得硫酸铁固体,$\rm D$正确;
故选:D
| 盐类水解在生活中的应用题目答案及解析(完整版)
