高中 | 原子的基态与激发态、光谱 题目答案及解析
稿件来源:高途
高中 | 原子的基态与激发态、光谱题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
原子的基态与激发态、光谱
氯是生命活动中不可或缺的元素。请回答:
关于Ⅶ$\rm A$族元素原子结构与性质的描述,下列说法正确的是$(\quad\ \ \ \ )$。
基态$\\text{F}$原子的电子占据的最高能级的轨道形状是球形
","电子排布为$\\left[ \\text{Ne} \\right]3{{\\text{s}}^{1}}3{{\\text{p}}^{6}}$的$\\text{Cl}$原子电子跃迁时,由光谱仪可能捕捉到发射光谱
","$\\text{Br}$的半径大于$\\text{B}{{\\text{r}}^{-}}$的半径
","$\\rm I$元素的原子序数为$\\rm 53$
"]$\rm A$.基态$\text{F}$原子的电子占据的最高能级为$\rm 2p$能级,轨道形状是哑铃形,而不是球形, $\rm A$ 错误;
$\rm B$.电子排布为$\left[ \text{Ne} \right]3{{\text{s}}^{1}}3{{\text{p}}^{6}}$的$\text{Cl}$原子,当电子从高能级跃迁到低能级时,会释放能量,由光谱仪可能捕捉到发射光谱, $\rm B$正确;
$\rm C$.对于同一种元素来说,其原子半径小于阴离子半径,故$\text{Br}$的半径小于$\text{B}{{\text{r}}^{-}}$的半径,$\rm C$错误;
$\rm D$.$\rm I$元素位于第五周期Ⅶ$\rm A$族,原子序数为$\rm 53$,$\rm D$正确;
某含有结晶水的化合物的晶胞如图。
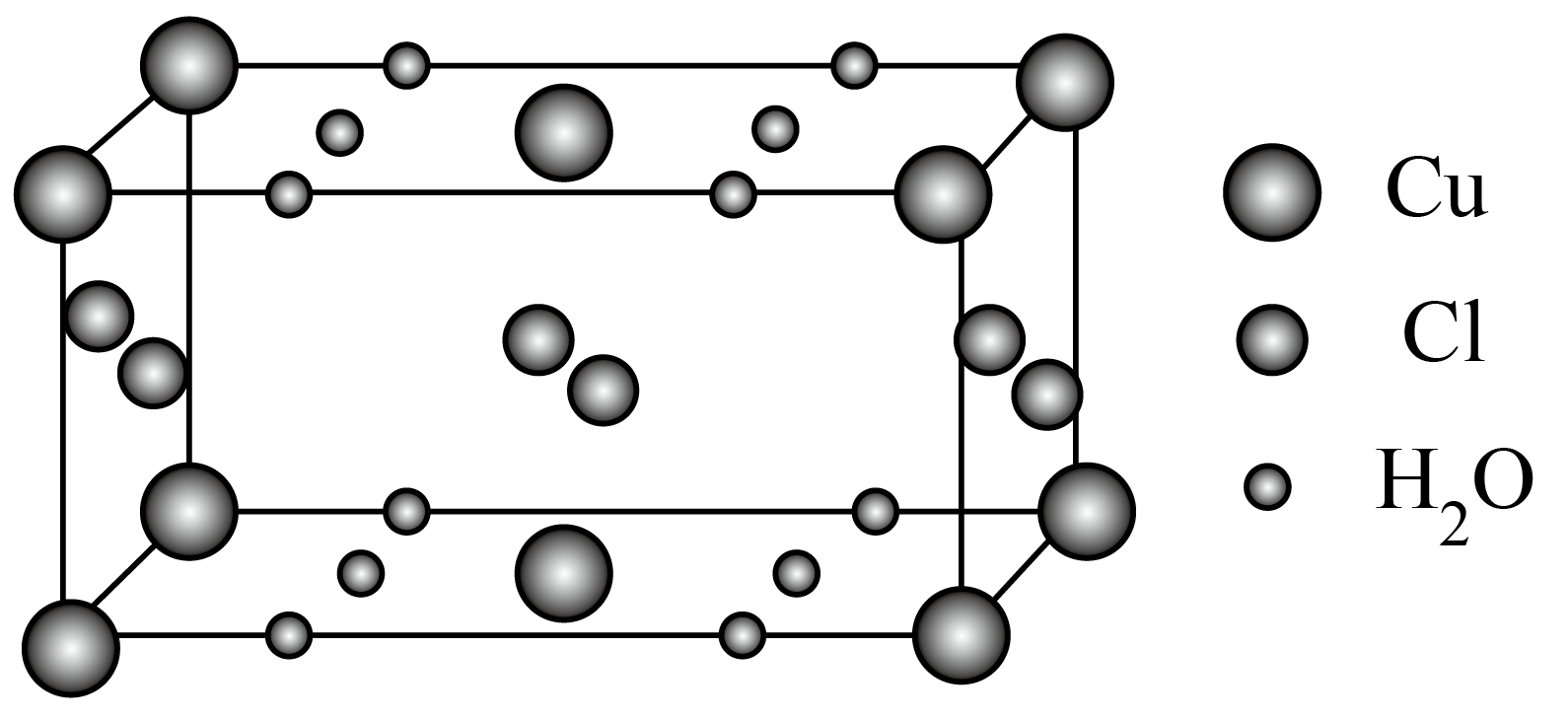
①化学式是 。
②将该化合物配成$0.5\ \text{mol}\cdot {{\text{L}}^{-1}}$的水溶液,然后取$2\;\rm \text{mL}$于试管中将其加热,实验现象是 $\rm ($从平衡移动角度考虑$\rm )$。
$\\text{CuC}{{\\text{l}}_{2}}\\cdot 2{{\\text{H}}_{2}}\\text{O}$;溶液由蓝色变为$\\rm ($黄$\\rm )$绿色
"]]①根据晶胞结构,顶点上的$\rm Cu$原子被$\rm 8$个晶胞共用,面上的$\rm Cu$原子被$\rm 2$个晶胞共用。晶胞中$\rm Cu$原子位于$\rm 8$个顶点和$\rm 2$个面心,利用均摊法,$\rm Cu$原子个数为$\dfrac{1}{8}\times 8+\dfrac{1}{2}\times 2=2$。$\rm Cl$原子位于晶胞内部和面上,晶胞内部的全部属于该晶胞,面上的$\rm Cl$原子被$\rm 2$个晶胞共用,$\rm Cl$原子个数为$2+\dfrac{1}{2}\times 4=4$。$\rm H_{2}O$分子位于棱上和面上,棱上的分子被$\rm 4$个晶胞共用,面上的分子被$\rm 2$个晶胞共用,$\rm H_{2}O$分子个数为$\dfrac{1}{4}\times 8+\dfrac{1}{2}\times 4=4$。$\text{N}\left( \text{Cu} \right)\text{:N}\left( \text{Cl} \right)\text{:N}\left( {{\text{H}}_{\text{2}}}\text{O} \right)=2:4:4=1:2:2$,所以该含有结晶水化合物的化学式是$\text{CuC}{{\text{l}}_{2}}\cdot 2{{\text{H}}_{2}}\text{O}$。
②在$\rm CuCl_{2}$水溶液中存在如下平衡:$\rm {{[{ Cu(}{{{H}}_{{2}}}{O}{{{)}}_{{4}}}]}^{{2+}}}{+4C}{{{l}}^{-}}\rightleftharpoons {{[{ CuC}{{{l}}_{{4}}}]}^{{2-}}}{+4}{{{H}}_{{2}}}{O}$。$\rm {{[ { Cu(}{{{H}}_{{2}}}{O}{{{)}}_{{4}}}]}^{{2+}}}$(水合铜离子)在溶液中呈蓝色 ,$\rm {{[{ CuC}{{{l}}_{{4}}}]}^{{2-}}}$在溶液中呈 $\rm ($黄$\rm )$ 绿色 。加热过程中,水会不断挥发,平衡正向移动,随着平衡正向移动,$\rm {{[ { Cu(}{{{H}}_{{2}}}{O}{{{)}}_{{4}}}]}^{{2+}}}$不断转化为$\rm {{[ { CuC}{{{l}}_{{4}}}]}^{{2-}}}$ ,$\rm {{[ { Cu(}{{{H}}_{{2}}}{O}{{{)}}_{{4}}}]}^{{2+}}}$浓度逐渐减小,$\rm {{[ { CuC}{{{l}}_{{4}}}]}^{{2-}}}$浓度逐渐增大,所以溶液颜色由蓝色逐渐变为 $\rm ($黄$\rm )$ 绿色。
已知常压下$\text{N}{{\text{H}}_{4}}\text{Cl}$的分解温度为$\rm 337\;\rm ^\circ\rm C$,$\text{N}{{\text{H}}_{4}}\text{Br}$的分解温度为$\rm 452\;\rm ^\circ\rm C$,从化学键角度分析两者分解温度差异的原因 。
$\\text{Cl}$原子半径小,$\\text{H}-\\text{Cl}$键能大,$\\text{N}{{\\text{H}}_{4}}\\text{Cl}$分解温度低
"]]卤化铵的分解过程是质子传递反应,其热稳定性与对应的卤化氢$\rm (HX)$的稳定性直接相关。$\rm HX$ 越稳定,对应的铵盐越容易分解。$\text{Cl}$原子半径小,$\text{H}-\text{Cl}$键能大于$\text{H}-\text{Br}$键能,说明$\rm HCl$稳定性更强,对应的铵盐$\text{N}{{\text{H}}_{4}}\text{Cl}$更容易分解,所以$\text{N}{{\text{H}}_{4}}\text{Cl}$的分解温度比$\text{N}{{\text{H}}_{4}}\text{Br}$分解温度低。
$\text{C}{{\text{l}}_{2}}\text{O}$是高效安全消毒灭菌剂,某兴趣小组设计了两种制备$\text{C}{{\text{l}}_{2}}\text{O}$的方法:
$\rm I$.用新制的$\text{HgO}$和$\text{C}{{\text{l}}_{2}}$反应。

已知:
$\rm i.\text{HgO}+2\text{C}{{\text{l}}_{2}}=\text{HgC}{{\text{l}}_{2}}+\text{C}{{\text{l}}_{2}}\text{O}$,副反应:$2\text{HgO}+2\text{C}{{\text{l}}_{2}}=2\text{HgC}{{\text{l}}_{2}}+{{\text{O}}_{2}}$
ⅱ$\rm .$常压下,$\text{C}{{\text{l}}_{2}}$沸点$\rm -34.0\;\rm ^\circ\rm C$,熔点$\rm -101.0\;\rm ^\circ\rm C$;$\text{C}{{\text{l}}_{2}}\text{O}$沸点$\rm 2.0\;\rm ^\circ\rm C$,熔点$\rm -120.6\;\rm ^\circ\rm C$;${{\text{O}}_{2}}$沸点$\rm -183\;\rm ^\circ\rm C$,熔点$\rm -218\;\rm ^\circ\rm C$。
ⅲ$\rm .\text{C}{{\text{l}}_{2}}\text{O}$在$\text{CC}{{\text{l}}_{4}}$中的溶解度远大于其在水中的溶解度。
Ⅱ$\rm .$将$\text{C}{{\text{l}}_{2}}$通入过量潮湿的$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$。
①方法$\rm I$,所得物质$\text{A}$的成分是 。将纯化后的$\text{C}{{\text{l}}_{2}}\text{O}$产品气化,通入水中得到高纯度$\text{C}{{\text{l}}_{2}}\text{O}$的浓溶液,于阴凉暗处贮存。当需要$\text{C}{{\text{l}}_{2}}\text{O}$时,可将$\text{C}{{\text{l}}_{2}}\text{O}$浓溶液用$\text{CC}{{\text{l}}_{4}}$ $\rm ($操作名称$\rm )$,得到的混合液再经过 $\rm ($操作名称$\rm )$,可重新得到$\text{C}{{\text{l}}_{2}}\text{O}$。
②写出方法Ⅱ中的化学反应方程式 。
③$\text{Cl}{{\text{O}}_{2}}$也是一种高效安全消毒灭菌剂。现有一瓶气体$\text{X}$,可能是$\text{Cl}{{\text{O}}_{2}}$或$\text{C}{{\text{l}}_{2}}\text{O}$。已知$\text{Cl}{{\text{O}}_{2}}$或$\text{C}{{\text{l}}_{2}}\text{O}$都可完全分解,产物都是$\text{C}{{\text{l}}_{2}}$和${{\text{O}}_{2}}$。请设计实验通过分解产物来确定气体$\text{X}$是哪种化合物 。
$\\text{C}{{\\text{l}}_{2}}\\text{O}$、$\\text{C}{{\\text{l}}_{2}}$;萃取,分液;气化$\\rm ($加热、蒸馏$\\rm )$;$2\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{O}}_{3}}+2\\text{C}{{\\text{l}}_{2}}+{{\\text{H}}_{2}}\\text{O}=\\text{C}{{\\text{l}}_{2}}\\text{O}\\uparrow +2\\text{NaHC}{{\\text{O}}_{3}}+2\\text{NaCl}$;$2\\text{C}{{\\text{l}}_{2}}\\text{O}=2\\text{C}{{\\text{l}}_{2}}+{{\\text{O}}_{2}}$ 、 $2\\text{Cl}{{\\text{O}}_{2}}=\\text{C}{{\\text{l}}_{2}}+2{{\\text{O}}_{2}}$,取一定体积的气体在一定条件下使其完全分解,然后向分解产物中加入足量氢氧化钠溶液,剩余$\\dfrac{1}{3}$体积的是$\\text{C}{{\\text{l}}_{2}}\\text{O}$,剩余$\\dfrac{2}{3}$体积的是$\\text{Cl}{{\\text{O}}_{2}}$
"]]①由制备流程可知,$\text{HgO}$和$\text{C}{{\text{l}}_{2}}$在$\rm 18\sim 25\;\rm ^\circ\rm C$反应生成$\text{C}{{\text{l}}_{2}}\text{O}$等气体,因$\text{C}{{\text{l}}_{2}}$沸点$\rm -34.0\;\rm ^\circ\rm C$,$\text{C}{{\text{l}}_{2}}\text{O}$沸点$\rm 2.0\;\rm ^\circ\rm C$,$\rm O_{2}$沸点$\rm -183\;\rm ^\circ\rm C$,在$\rm -80\sim -60\;\rm ^\circ\rm C$充分冷却时,$\text{C}{{\text{l}}_{2}}$和$\text{C}{{\text{l}}_{2}}\text{O}$会被冷凝,所以物质$\rm A$的成分是$\text{C}{{\text{l}}_{2}}\text{O}$、$\text{C}{{\text{l}}_{2}}$。已知$\text{C}{{\text{l}}_{2}}\text{O}$在$\text{CC}{{\text{l}}_{4}}$中的溶解度远大于其在水中的溶解度,要从$\text{C}{{\text{l}}_{2}}\text{O}$浓溶液中得到$\text{C}{{\text{l}}_{2}}\text{O}$,先利用萃取剂(如$\text{CC}{{\text{l}}_{4}}$)萃取$\text{C}{{\text{l}}_{2}}\text{O}$,然后进行分液得到含$\text{C}{{\text{l}}_{2}}\text{O}$的有机层,最后通过气化(加热、蒸馏 )使$\text{C}{{\text{l}}_{2}}\text{O}$从有机层中分离出来。所以操作名称依次为萃取,分液;气化$\rm ($加热、蒸馏$\rm )$。
②方法Ⅱ将$\text{C}{{\text{l}}_{2}}$通入过量潮湿的$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$制备$\text{C}{{\text{l}}_{2}}\text{O}$,根据原子守恒和得失电子守恒,反应的化学方程式为$2\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}+2\text{C}{{\text{l}}_{2}}+{{\text{H}}_{2}}\text{O}=\text{C}{{\text{l}}_{2}}\text{O}\uparrow +2\text{NaHC}{{\text{O}}_{3}}+2\text{NaCl}$。
③已知$\text{Cl}{{\text{O}}_{2}}$或$\text{C}{{\text{l}}_{2}}\text{O}$都可完全分解,产物都是$\text{C}{{\text{l}}_{2}}$和${{\text{O}}_{2}}$,方程式分别为$2\text{Cl}{{\text{O}}_{2}}=\text{C}{{\text{l}}_{2}}+2{{\text{O}}_{2}}$,$2\text{C}{{\text{l}}_{2}}\text{O}=2\text{C}{{\text{l}}_{2}}+{{\text{O}}_{2}}$,由此可知$\text{Cl}{{\text{O}}_{2}}$分解产生的$\text{C}{{\text{l}}_{2}}$和${{\text{O}}_{2}}$体积比为$\rm 1:2$,$\text{C}{{\text{l}}_{2}}\text{O}$分解产生的$\text{C}{{\text{l}}_{2}}$和${{\text{O}}_{2}}$体积比$\rm 2:1$。设计实验通过分解产物来确定气体$\text{X}$是哪种化合物,可取一定体积的气体在一定条件下使其完全分解,然后向分解产物中加入足量氢氧化钠溶液,由于$\text{C}{{\text{l}}_{2}}$能与氢氧化钠溶液反应,${{\text{O}}_{2}}$不与氢氧化钠溶液反应,所以剩余$\dfrac{1}{3}$体积的是$\text{C}{{\text{l}}_{2}}\text{O}$,剩余$\dfrac{2}{3}$体积的是$\text{Cl}{{\text{O}}_{2}}$。
高中 | 原子的基态与激发态、光谱题目答案及解析(完整版)
