高中 | 原子晶体 题目答案及解析
稿件来源:高途
高中 | 原子晶体题目答案及解析如下,仅供参考!
选修三
第三章 晶体结构与性质
第二节 分子晶体与原子晶体
原子晶体
碳、硅及其化合物具有丰富的理化性质和用途。
硅在元素周期表中的位置是 ,基态硅原子占据的最高能级的符号是 。
第三周期Ⅳ$\\rm A$族 ; $\\rm 3p$
"]]硅原子序数$\rm 14$,位于元素周期表第三周期Ⅳ$\rm A$族,核外电子排布:$\text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{6}}}\text{3}{{\text{s}}^{\text{2}}}\text{3}{{\text{p}}^{\text{2}}}$,基态硅原子占据的最高能级的符号是$\rm 3p$;
$\rm CaC_{2}$俗称电石,该化合物中存在的化学键类型为 。$\rm ($不定项$\rm )$。
$\rm A$.离子键 $\rm B$.极性共价键 $\rm C$.非极性共价键 $\rm D$.配位键
$\\rm AC$
"]]电石属于离子化合物,存在离子键,还存在碳碳非极性共价键;
下列说法正确的是 。$\rm ($不定项$\rm )$
$\rm A$.电负性:$\rm B\gt N\gt O$ $\rm B$.离子半径:$\rm P^{3-}\lt S^{2-}\lt Cl^{-}$
$\rm C$.第一电离能:$\rm Si\lt S\lt P$ $\rm D$.基态$\rm Cr^{2+}$的简化电子排布式:$\rm [Ar]3d^{4}$
$\\rm CD$
"]]$\rm A$.同周期元素,从左到右元素电负性逐渐增强,电负性:$\rm B\lt N\lt O$,$\rm A$错误;
$\rm B$.电子层数越大,离子半径越大,电子层数相同,原子序数越大,离子半径越小,离子半径:$\rm P^{3-}\gt S^{2-}\gt Cl^{-}$,$\rm B$错误;
$\rm C$.同周期元素,从左到右元素第一电离能呈逐渐增大趋势,$\rm P$核外电子排布处于半充满的较稳定状态,第一电离能大于相邻族元素,则第一电离能:$\rm Si\lt S\lt P$,$\rm C$正确;
$\rm D$.$\rm Cr$原子序数$\rm 24$,基态$\rm Cr^{2+}$的简化电子排布式:$\rm [Ar]3d^{4}$,$\rm D$正确;
早在青铜器时代,人类就认识了与碳硅同主族的锡。锡的卤化物熔点数据如下表,
| 物质 | $\rm SnF_{4}$ | $\rm SnCl_{4}$ | $\rm SnBr_{4}$ | $\rm SnI_{4}$ |
| 熔点$\rm /^\circ\rm C$ | $\rm 442$ | $\rm -34$ | $\rm 29$ | $\rm 143$ |
$\rm SnCl_{4}$气态分子的空间构型是 。
$\rm A$.正四面体形 $\rm B$.三角锥形 $\rm C$.角形 $\rm D$.直线形
$\\rm A$
"]]$\rm SnCl_{4}$中$\rm Sn$杂化类型为$\rm sp^{3}$,无孤电子对,空间结构为正四面体;
结合变化规律说明上述熔点变化的原因: 。
$\\rm SnF_{4}$属于离子晶体,熔点较高,$\\rm SnCl_{4}$、$\\rm SnBr_{4}$、$\\rm SnI_{4}$属于分子晶体,分子晶体的相对分子量越大,分子间作用力越强,熔点越高
"]]$\rm SnF_{4}$属于离子晶体,熔点较高,$\rm SnCl_{4}$、$\rm SnBr_{4}$、$\rm SnI_{4}$属于分子晶体,分子晶体的相对分子量越大,分子间作用力越强,熔点越高;
下列物质均为共价晶体且成键结构相似,其中熔点最低的是 。
$\rm A$.金刚石$\rm (C)$ $\rm B$.单晶硅$\rm (Si)$ $\rm C$.金刚砂$\rm (SiC)$ $\rm D$.氮化硼$\rm (BN$,立方相$\rm )$
$\\rm B$
"]]共价晶体熔化时需破坏共价键,成键原子半径越小,键长越短,键能越大,熔点越高,则熔点最低的为单晶硅$\rm (Si)$;
$\rm Mg_{2}Si$晶体的晶胞示意图如下。每个$\rm Mg$原子位于$\rm Si$原子组成的四面体的中心。则$\rm 1$个$\rm Si$原子周围有 个紧邻的$\rm Mg$原子。已知$\rm Mg_{2}Si$的晶胞边长为$a\,\text{cm}$,阿伏加德罗常数的值为${{N}_{\text{A}}}$,则$\rm Mg_{2}Si$晶体的密度为 $\rm \;\rm g·cm^{-3}$。
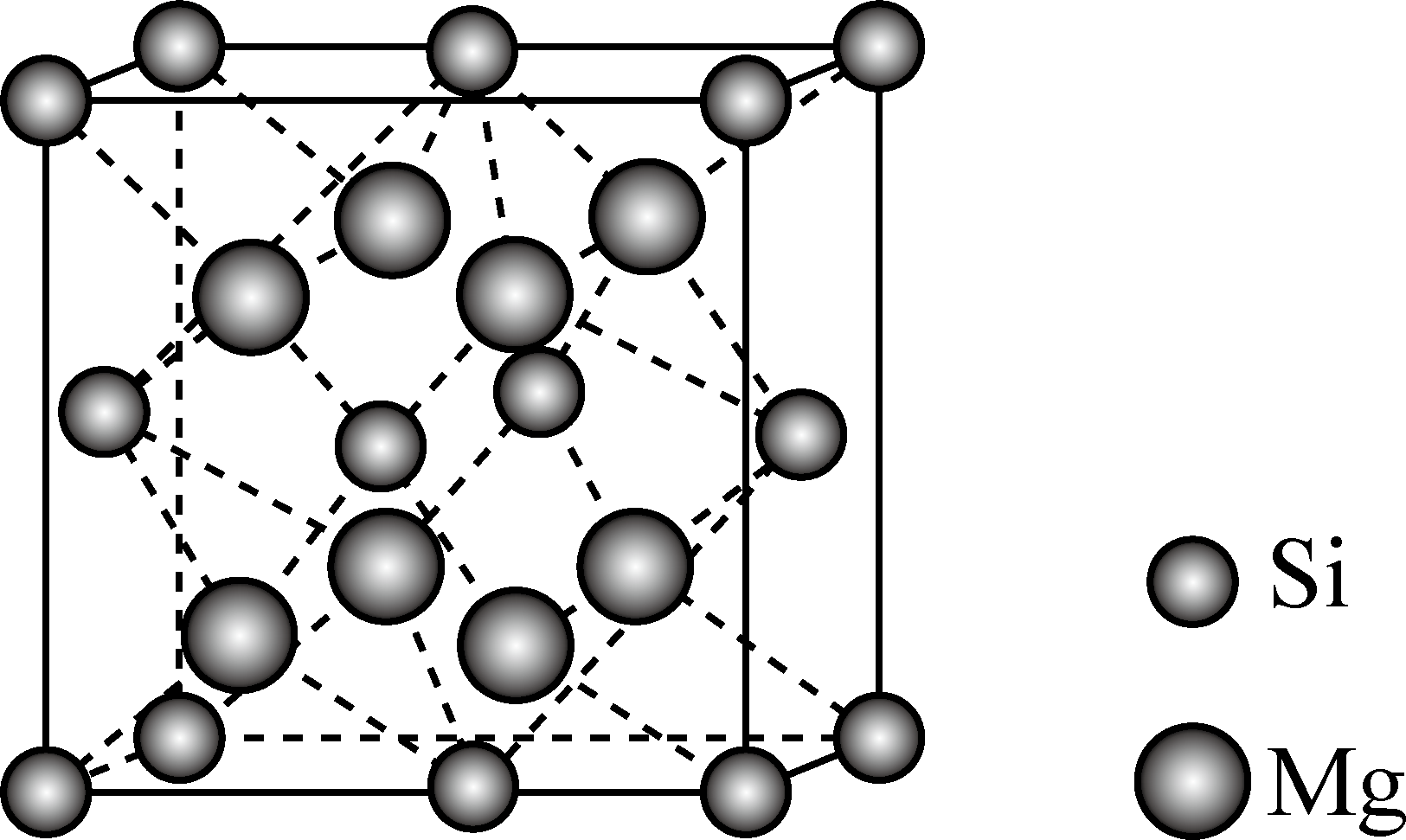
$\\rm 8$ ; $\\dfrac{4\\times 76}{{{a}^{3}}\\times {{N}_{\\text{A}}}}$
"]]根据$\rm Mg_{2}Si$晶体的晶胞示意图可知,$\rm 1$个$\rm Si$原子周围有$\rm 8$个紧邻的$\rm Mg$原子;$\rm Si$位于顶角和面心,个数:$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$,$\rm Mg$位于晶胞内部,个数为$\rm 8$,晶胞密度:$\rho =\dfrac{NM}{{{N}_{\text{A}}}V}=\dfrac{4\times 76}{{{a}^{3}}\times {{N}_{\text{A}}}}$。
高中 | 原子晶体题目答案及解析(完整版)
