高中 | 卤族元素 题目答案及解析
稿件来源:高途
高中 | 卤族元素题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第一节 元素周期表
卤族元素
$\rm M$、$\rm X$、$\rm Y$、$\rm Z$、$\rm W$为原子序数依次增大的短周期元素,$\rm M$、$\rm X$、$\rm Y$、$\rm Z$的原子半径依次减小,$\rm W$元素的最高正价与最低负价的代数和为$\rm 4$。由这五种元素组成的阴离子的结构如下图所示。下列说法正确的是$(\quad\ \ \ \ )$
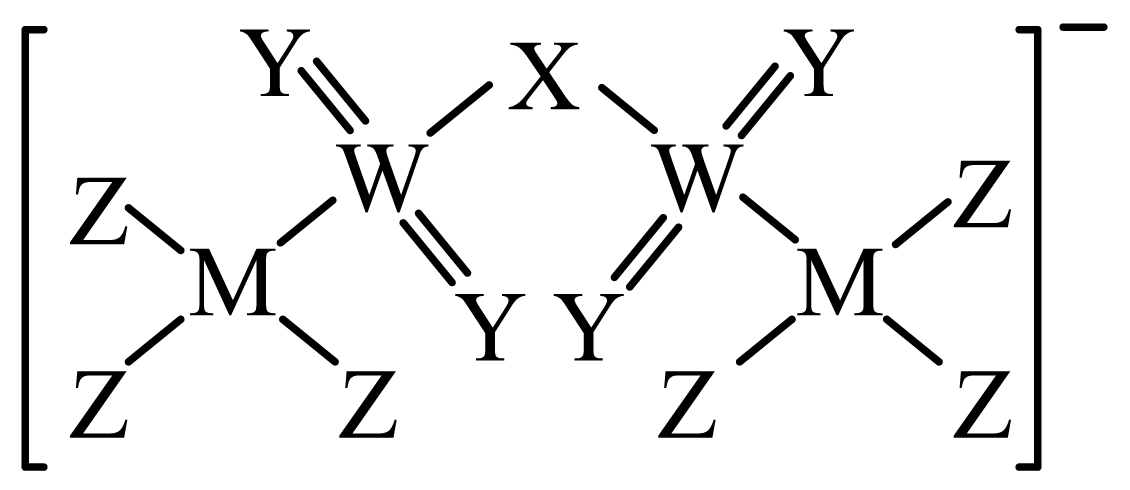
键角:$\\text{M}{{\\text{Z}}_{4}}\\gt \\text{X}{{\\text{Z}}_{3}}$
","离子半径:$\\text{W}\\gt \\text{Y}\\gt \\text{X}\\gt \\text{Z}$
","$\\rm Z$的单质能从溴化钠水溶液中置换出溴单质
","单质$\\rm W$在${{\\text{Y}}_{2}}$中燃烧生成$\\text{W}{{\\text{Y}}_{3}}$
"]$\rm M$、$\rm X$、$\rm Y$、$\rm Z$的原子半径依次减小,则$\rm M$、$\rm X$、$\rm Y$、$\rm Z$为同一周期元素,$\rm W$元素的最高正价与最低负价的代数和为$\rm 4$,则$\rm W$为$\rm S$,根据结构式,$\rm M$、$\rm X$、$\rm Y$、$\rm Z$分别形成$\rm 4$、$\rm 2$、$\rm 2$、$\rm 1$个共价键,则$\rm M$、$\rm X$、$\rm Y$、$\rm Z$分别为$\rm C$、$\rm N$、$\rm O$、$\rm F$。
$\rm A$.$\rm C$和$\rm N$均为$\rm sp^{3}$杂化,由于$\rm NF_{3}$中存在孤电子对,因此$\rm CF_{4}$键角大于$\rm NF_{3}$,故$\rm A$正确;
$\rm B$.$\rm N^{3-}$、$\rm O^{2-}$、$\rm F^{-}$为$\rm 10$电子,$\rm S^{2-}$为$\rm 18$电子,核外电子数越多半径越大,相同核外电子数的离子,原子序数越小半径越大,则离子半径:$\text{W}\gt \text{X}\gt \text{Y}\gt \text{Z}\rm ({{\text{S}}^{2-}}\gt {{\text{N}}^{3-}}\gt {{\text{O}}^{2-}}\gt {{\text{F}}^{-}}\rm )$,故$\rm B$错误;
$\rm C$.$\rm F_{2}$先与水反应,不能置换溴,故$\rm C$错误;
$\rm D$.$\rm S$在$\rm O_{2}$中燃烧只生成$\rm SO_{2}$,故$\rm D$错误;
故选:$\rm A$
高中 | 卤族元素题目答案及解析(完整版)
