高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
乙二醇是一种重要的化工原料,可用于生产聚酯纤维、防冻剂、增塑剂、不饱和聚酯树脂等。由合成气直接合成乙二醇的主要反应过程如下:
$\rm I$.$\text{2CO(g)+3}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{HOC}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(g)}\quad \Delta {{H}_{\text{1}}}$ ;
$\rm I$$\rm I$.$\text{CO(g)+2}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)}\quad \Delta {{H}_{\text{2}}}$ 。
已知$\text{298 K}、\text{101 kPa}$下:$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{CO(g)+}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta H\text{=+41}\text{.0 kJ/mol}$ ;$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+3}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)+}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta H\text{=-49}\text{.0 kJ/mol}$ 则反应Ⅱ的$\Delta {{H}_{2}}=$ ;反应Ⅱ的正反应活化能 $\rm ($填“大于”、“小于”或“等于”$\rm )$逆反应活化能。
$\\text{-90}\\text{.0 kJ/mol}$ ; 小于
"]]$\text{298\ K}、\text{101\ kPa}$下:①$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{CO(g)+}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta H\text{=+41}\text{.0 kJ/mol}$;
②$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+3}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)+}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta H\text{=-49}\text{.0 kJ/mol}$
盖斯定律②$\rm -$①得反应Ⅱ $\text{CO(g)+2}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)}\quad \Delta {{H}_{2}}=\text{-49}\text{.0 kJ/mol-41}\text{.0 kJ/mol=-90}\text{.0 kJ/mol}$;反应Ⅱ放热,正反应活化能小于逆反应活化能。
在恒温恒容下,若只发生反应$\rm I$,如果从反应物出发建立平衡,一定能说明反应达到平衡状态的是 $\rm ($填选项字母$\rm )$。
$\rm A$.体系压强不再变化 $\rm B$.两种反应物的比值保持不变
$\rm C$.混合气体的密度保持不变 $\rm D$.气体平均相对分子质量保持不变
$\\rm AD$
"]]$\rm A$.正反应化学计量数之和减小,压强是变量,体系压强不再变化,反应一定达到平衡状态,故选:$\rm A$;
$\rm B$.若投料比等于化学计量数之比,两种反应物的比值是恒量,则两种反应物的比值保持不变,反应不一定平衡,故不选$\rm B$;
$\rm C$.反应前后气体总质量不变、容器体积不变,密度是恒量,混合气体的密度保持不变,反应不一定平衡,故不选$\rm C$;
$\rm D$.反应前后气体总质量不变,正反应化学计量数之和减小,气体平均相对分子质量是变量,气体平均相对分子质量保持不变,反应一定达到平衡状态,故选:$\rm D$;
在$\rm 1$ $\rm L$刚性容器中充入合成气$\rm CO$和$\rm H_{2}$,发生反应Ⅰ和反应Ⅱ,在温度$\rm 473$ $\rm K$,催化剂$\rm Rh_{4}(CO)_{12}$ $\rm ($含$\rm 0.8$ $\rm mg-Rh)$下进行反应。
①测得$\rm HOCH_{2}CH_{2}OH(g)$和$\rm CH_{3}OH(g)$的时空收率分别为$\rm 1.0$ $\rm mol·(mg-Rh)^{-1}·h^{-1}$和$\rm 0.5$ $\rm mol·(mg-Rh)^{-1}·h^{-1}$。$\rm ($时空收率$\rm =$产物物质的量$\text{/(催化剂的用量}\times 反应时间\text{)}\rm )$,则用$\rm CO$表示反应速率为 $\text{mol}\cdot {{\text{L}}^{\text{-1}}}\cdot {{\text{h}}^{\text{-1}}}$。
②若起始总压$\rm 30$ $\rm MPa$,充入合成气$\rm CO$和$\rm H_{2}$物质的量之比为$1:2$,平衡时$\rm HOCH_{2}CH_{2}OH(g)$和$\rm CH_{3}OH(g)$的物质的量之比为$1:1$,$\rm H_{2}$的平衡分压为$\rm 5$ $\rm MPa$,则反应Ⅱ的平衡常数${{K}_{\text{p}}}=$ $\rm (MPa)^{-2}($结果用分数表示,分压$\rm =$总压$\rm \times $物质的量分数$\rm )$。
$\\rm 2$ ; $\\dfrac{3}{25}$
"]]①生成$\rm HOCH_{2}CH_{2}OH(g)$的速率为$\rm 1.0$ $\rm mol·(mg-Rh)^{-1}·h^{-1}\times 0.8$ $\rm mg-Rh$ $\rm =0.8$ $\rm mol·h^{-1}$,生成$\rm CH_{3}OH(g)$的速率为$\rm 0.5$ $\rm mol·(mg-Rh)^{-1}·h^{-1}\times 0.8$ $\rm mg-Rh$ $\rm =0.4$ $\rm mol·h^{-1}$,根据碳守恒,消耗$\rm CO$的速率为$\rm 0.8$ $\rm mol·h^{-1}\times 2+0.4$ $\rm mol·h^{-1}=$ $\rm 2$ $\rm mol·h^{-1}$,则用$\rm CO$表示反应速率为$\rm 2$ $\rm mol·h^{-1}\div 1$ $\rm L=2\ \text{mol}\cdot {{\text{L}}^{\text{-1}}}\cdot {{\text{h}}^{\text{-1}}}$。
②设$\rm CO$的投料为$a$ $\rm mol$、$\rm H_{2}$的投料为$2a\text{ }$ $\rm mol$;平衡时$\rm HOCH_{2}CH_{2}OH(g)$和$\rm CH_{3}OH(g)$的物质的量均为$b$ $\rm mol$;则反应消耗$\rm CO$的物质的量为$3b\text{ mol}$,消耗$\rm H_{2}$的物质的量为$5b$ $\rm mol$,则平衡体系中剩余$\rm CO$的物质的量为$\left( a-3b \right)$ $\rm mol$、$\rm H_{2}$的物质的量为$\left( 2a-5b \right)$ $\rm mol$,则$\dfrac{3a}{2a-5b}=\dfrac{30}{5},b=0.3a$,平衡体系中$\rm CO$的物质的量为$0.1a\text{ mol}$、$\rm H_{2}$的物质的量为$0.5a$ $\rm mol$,$\rm HOCH_{2}CH_{2}OH(g)$和$\rm CH_{3}OH(g)$的物质的量均为$0.3a$ $\rm mol$;平衡总压为$\dfrac{30\times 1.2a}{3a}=12\text{ MPa}$,则反应Ⅱ的平衡常数 ${{K}_{\text{p}}}=\dfrac{12\times \dfrac{0.3a}{1.2a}}{\left( 12\times \dfrac{0.1a}{1.2a} \right)\times {{\left( 12\times \dfrac{0.5a}{1.2a} \right)}^{2}}}=\dfrac{3}{25}$ $\rm (MPa)^{-2}$。
若一定条件下只发生反应$\rm I$,测得$\rm HOCH_{2}CH_{2}OH(g)$时空收率随温度的变化曲线如图所示。
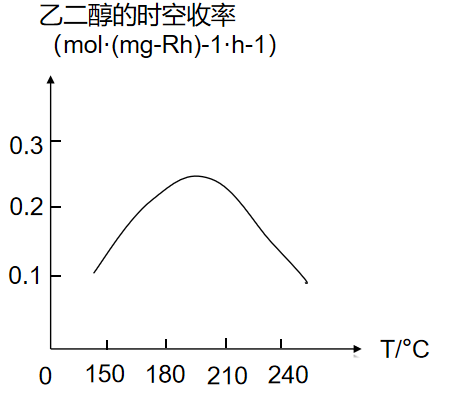
①$\text{2CO(g)+3}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{HOC}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(g)}\quad \Delta {{H}_{\text{1}}}$ $\rm 0($填“大于”、“小于”或“等于”$\rm )$。
②$\rm HOCH_{2}CH_{2}OH(g)$时空收率随温度升高先增大后减小的原因是 。
小于 ; 当温度较低时,反应速率较慢,随温度升高,反应速率加快,$\\rm CH_{3}OH$时空收率增大;当温度较高,反应速率较快,反应达到平衡,升高温度,平衡逆向移动,$\\rm CH_{3}OH$的转化率减小,$\\rm CH_{3}OH$时空收率减小
"]]①根据图像,随温度升高,$\rm HOCH_{2}CH_{2}OH(g)$时空收率降低,可知升高温度平衡逆向移动,则$\text{2CO(g)+3}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{HOC}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(g)}\quad \Delta {{H}_{\text{1}}}$ 小于$\rm 0$。
②当温度较低时,反应速率较慢,随温度升高,反应速率加快,$\rm CH_{3}OH$时空收率增大;当温度较高,反应速率较快,反应达到平衡,升高温度,平衡逆向移动,$\rm CH_{3}OH$的转化率减小,$\rm CH_{3}OH$时空收率减小;所以$\rm HOCH_{2}CH_{2}OH(g)$时空收率随温度升高先增大后减小。
高中 | 化学平衡常数题目答案及解析(完整版)
