高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
天然气开发和利用是热点研究课题。
$\rm I$.工业上,利用天然气脱硝。反应原理如下:
$\rm a$.$\text{2N}{{\text{O}}_{\text{2}}}\text{(g)+C}{{\text{H}}_{\text{4}}}\text{(g)}\rightleftharpoons \text{C}{{\text{O}}_{\text{2}}}\text{(g)+}{{\text{N}}_{\text{2}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\qquad \Delta{{ {H}}_{\text{1}}}\text{=-862} {.0\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
$\rm b$.$\text{2NO(g)+}{{\text{O}}_{\text{2}}}\text{(g)=2N}{{\text{O}}_{\text{2}}}\text{(g)}\qquad \Delta{{ {H}}_{\text{2}}}\text{=-112} {.0\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
$\rm c$.${{\text{N}}_{\text{2}}}\text{(g)+}{{\text{O}}_{\text{2}}}\text{(g)=2NO(g)}\qquad \Delta{{ {H}}_{\text{3}}}\text{=+176} {.0\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
$\text{4NO(g)+C}{{\text{H}}_{\text{4}}}\text{(g)}\rightleftharpoons \text{C}{{\text{O}}_{\text{2}}}\text{(g)+2}{{\text{N}}_{\text{2}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\qquad \Delta { H=}$ $\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。
$\\text{-1150}$
"]]$\rm a$.$\text{2N}{{\text{O}}_{\text{2}}}\text{(g)+C}{{\text{H}}_{\text{4}}}\text{(g)}\rightleftharpoons \text{C}{{\text{O}}_{\text{2}}}\text{(g)+}{{\text{N}}_{\text{2}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\qquad \Delta{{ {H}}_{\text{1}}}\text{=-862} {.0\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
$\rm b$.$\text{2NO(g)+}{{\text{O}}_{\text{2}}}\text{(g)=2N}{{\text{O}}_{\text{2}}}\text{(g)}\qquad \Delta{{ {H}}_{\text{2}}}\text{=-112} {.0\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
$\rm c$.${{\text{N}}_{\text{2}}}\text{(g)+}{{\text{O}}_{\text{2}}}\text{(g)=2NO(g)}\qquad \Delta{{ {H}}_{\text{3}}}\text{=+176} {.0\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
根据盖斯定律,该反应可由$\rm a+b-c$得到,则$\Delta H=\Delta H_{1}+\Delta H_{2}-\Delta H_{3}=(-862.0\;\rm kJ·mol^{-1})+(-112.0\;\rm kJ·mol^{-1})-(+176.0\; kJ·mol^{-1})=\text{-1150}\;\rm kJ·mol^{-1}$;
实验测得$\rm {4NO(g)+C}{{{H}}_{{4}}}{(g)}\rightleftharpoons {C}{{{O}}_{{2}}}{(g)+2}{{{N}}_{{2}}}{(g)+2}{{{H}}_{{2}}}{O(g)}$的速率方程为:${{{v}}_正{}}={{{k}}_正{}}\cdot {c}\left(\rm {C}{{{H}}_{{4}}} \right)\cdot {{{c}}^{{4}}}{\rm(NO)}$,${{{v}}_逆{}}={{{k}}_逆{}}\cdot {{{c}}^{{2}}}\left(\rm {{{N}}_{{2}}} \right)\cdot {c}\left(\rm {C}{{{O}}_{{2}}} \right)\cdot {{{c}}^{{2}}}\left(\rm {{{H}}_{{2}}}{O} \right) ({{{k}}_正{}}$、${{{k}}_逆{}}$为速率常数,只与温度、催化剂有关$\rm )$。达到平衡后,升高温度,则$\dfrac{{{{k}}_正{}}}{{{{k}}_逆{}}}$ $\rm ($填“增大”“减小”或“不变”$\rm )$。
减小
"]]达到平衡后,$v_{正}=v_{逆}$,则${{{k}}_正{}}\cdot {c}\left(\rm {C}{{{H}}_{{4}}} \right)\cdot {{{c}}^{{4}}}{\rm (NO)}={{{k}}_逆{}}\cdot {{{c}}^{{2}}}\left(\rm {{{N}}_{{2}}} \right)\cdot {c}\left(\rm {C}{{\rm {O}}_{{2}}} \right)\cdot {{{c}}^{{2}}}\left(\rm {{{H}}_{{2}}}{O} \right)$,$\dfrac{{{{k}}_正{}}}{{{{k}}_逆{}}} =\dfrac{{{{c}}^{2}}\left(\rm {{{N}}_{2}} \right)\times {c}\left(\rm {C}{{{O}}_{2}} \right)\times {{{c}}^{2}}\left(\rm {{{H}}_{2}}{O} \right)}{{c}\left(\rm {C}{{{H}}_{4}} \right)\times {{{c}}^{4}}\left(\rm {NO} \right)} =K$,该反应为放热反应,温度升高,$ K$减小,则$\dfrac{{{{k}}_正{}}}{{{{k}}_逆{}}}$减小;
Ⅱ.工业上,利用$\text{C}{{\text{H}}_{\text{4}}}$和$\text{C}{{\text{O}}_{\text{2}}}$制备合成气$\rm (\text{CO}$和${{\text{H}}_{\text{2}}}\rm )$,助力“碳中和”。其原理如下:
$\rm i$.$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+C}{{\text{H}}_{\text{4}}}\text{(g)}\rightleftharpoons \text{2CO(g)+2}{{\text{H}}_{\text{2}}}\text{(g)}$
$\rm ii$.$\text{3C}{{\text{O}}_{\text{2}}}\text{(g)+C}{{\text{H}}_{\text{4}}}\text{(g)}\rightleftharpoons \text{4CO(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}$
$\rm iii$.$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+3}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)+}{{\text{H}}_{\text{2}}}\text{O(g)}$
回答下列问题:
常温、常压下,$\text{C}{{\text{H}}_{\text{3}}}\text{OH}$呈液态,${{\text{O}}_{\text{2}}}$呈气态,其主要原因是 。
$\\text{C}{{\\text{H}}_{\\text{3}}}\\text{OH}$分子间存在氢键
"]]$\rm CH_{3}OH$分子间存在氢键,使其沸点高于$\rm O_{2}$;
一定条件下,向某恒容密闭容器中充入$\text{1\;\rm mol C}{{\text{O}}_{\text{2}}}$和$\text{1\;\rm mol }{{\text{H}}_{\text{2}}}$,仅发生上述反应$\rm iii$,分别在有、无催化剂的条件下反应相同时间,测得$\text{C}{{\text{O}}_{\text{2}}}$的转化率与温度的关系如图所示。
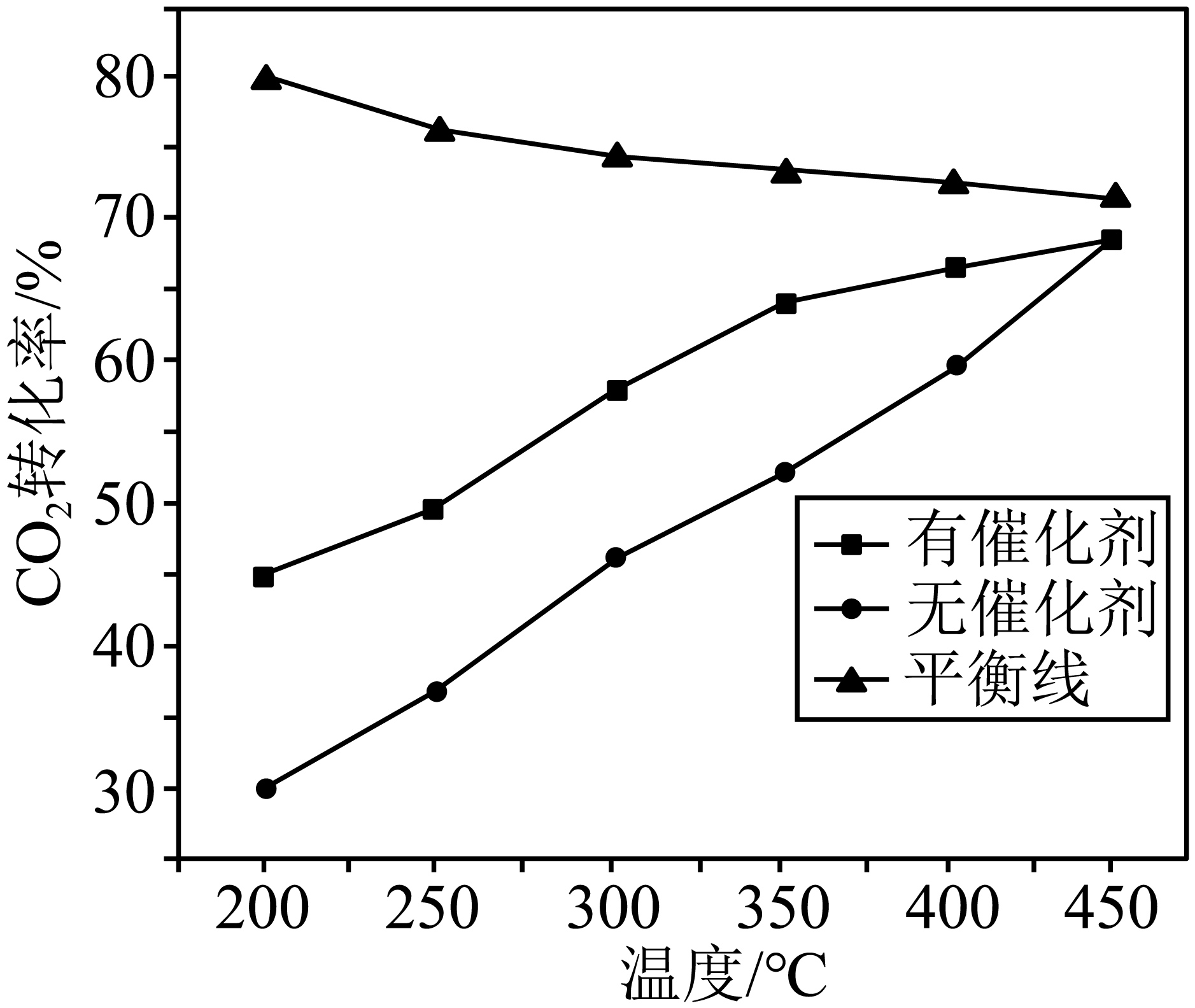
①下列情况表明反应已达到平衡状态的是 $\rm ($填字母$\rm )$。
$\rm A$.混合气体密度不随时间变化 $\rm B$.$\dfrac{ {n}\left[ \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)} \right]}{ {n}\left[ {{\text{H}}_{\text{2}}}\text{O(g)} \right]}$不随时间变化
$\rm C$.$\rm {{\text{H}}_{\text{2}}}$的转化率不随时间变化 $\rm D$.$\rm \text{C}{{\text{O}}_{\text{2}}}$的体积分数不随时间变化
②$450\;^\circ \rm C $时,在有、无催化剂的条件下,$\text{C}{{\text{O}}_{\text{2}}}$转化率相等原因可能是 。
$\\rm CD$;反应未达到平衡状态,催化剂失活
"]]①$\rm A$.该反应中反应物和产物均为气体,气体总质量不变,容器体积恒定,则混合气体密度恒定,不能据此判断平衡状态,故$\rm A$不符合题意;
$\rm B$.$\rm CH_{3}OH$和$\rm H_{2}O$均为生成物,$\dfrac{ {n}\left[ \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)} \right]}{ {n}\left[ {{\text{H}}_{\text{2}}}\text{O(g)} \right]}$恒定不变,不能据此判断平衡状态,故$\rm B$不符合题意;
$\rm C$.$\rm H_{2}$的转化率不随时间变化,说明氢气的物质的量浓度不再变化,可知反应达到平衡状态,故$\rm C$符合题意;
$\rm D$.反应正向进行过程中,$\rm CO_{2}$的体积分数逐渐减小,当不再变化时反应达到平衡状态,故$\rm D$符合题意;
②由图可知,$\rm 450\;\rm ^\circ\rm C$时,反应有、无催化剂时反应相同的时间均未达到平衡状态,在有、无催化剂的条件下,$\rm CO_{2}$转化率相等的原因可能是催化剂失活;
向恒容密闭反应器中充入$\text{1\;\rm mol C}{{\text{H}}_{\text{4}}}$和$\text{1\;\rm mol C}{{\text{O}}_{\text{2}}}$,仅发生反应$\rm i$和$\rm ii$,测得$\text{C}{{\text{O}}_{\text{2}}}$的平衡转化率与温度或压强的关系如图所示。
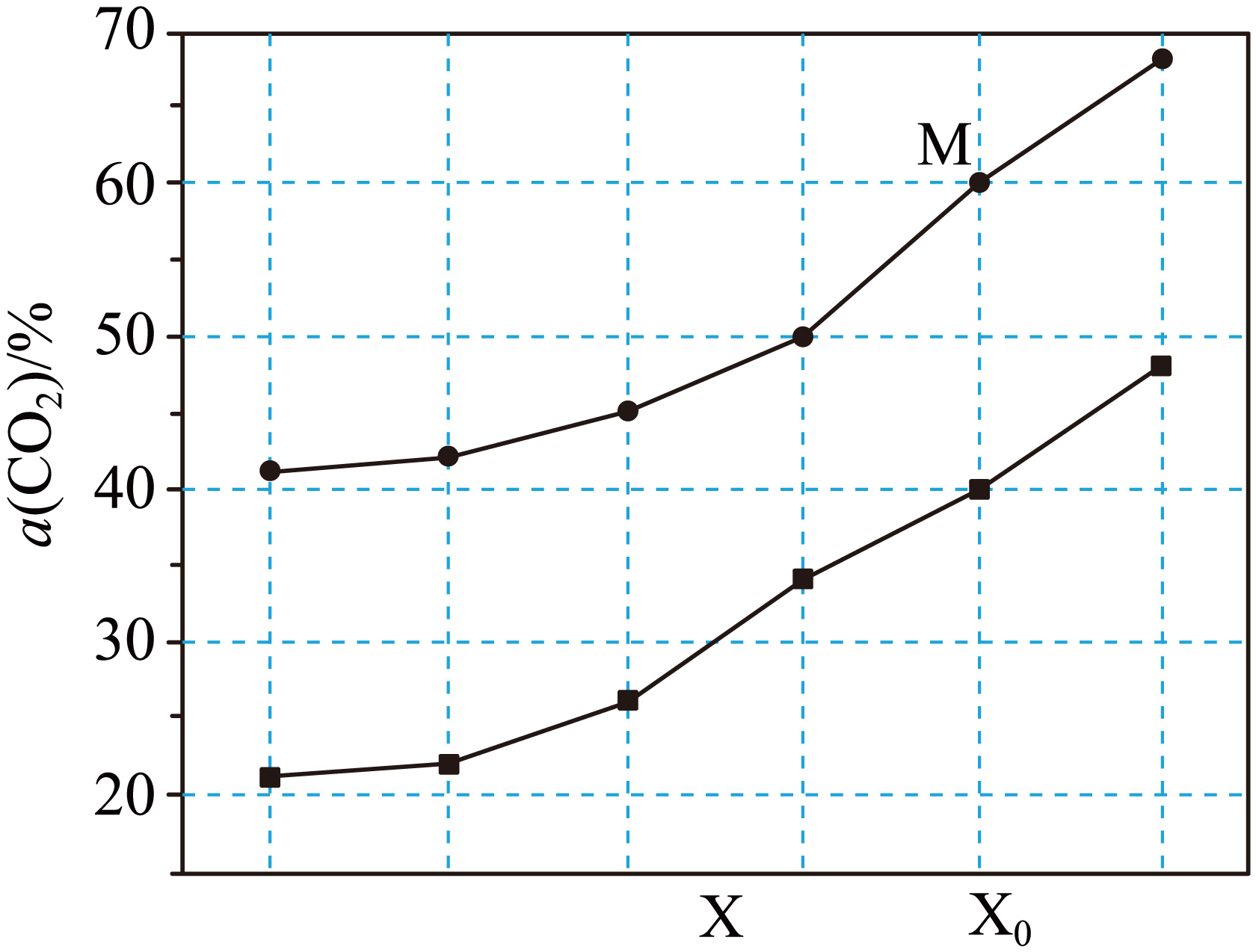
①图中$\rm X$表示的是 $\rm ($填“温度”或“压强”$\rm )$。
②测得$\rm M$点条件下,容器内$\text{CO}$的物质的量为$\text{1\;\rm mol}$,总压强为$\text{1}\text{.4 MPa}$,$\rm M$点对应条件下反应$\rm i$的${{ {K}}_{\text{p}}}$为 ${{\text{(MPa)}}^{\text{2}}}$。
温度;$\\rm 0.375$或$\\rm 3/8$
"]]①由反应可知,$\rm i$、$\rm ii$两反应正向气体分子数均增加,则增大压强时平衡均逆向移动,$\rm CO_{2}$的平衡转化率应减小,若$\rm X$表示压强,则曲线变化趋势与反应受压强的影响不一致,因此,$\rm X$表示的是温度;
②测得$\rm M$点条件下,容器内$\rm CO$的物质的量为$\rm 1\;\rm mol$,此时$\rm CO_{2}$转化率为$\rm 60\%$,则容器内$\rm CO_{2}$的物质的量为$\rm 0.4\;\rm mol$,根据$\rm C$原子守恒可知的$\rm CH_{4}$物质的量为$\rm (1+1-1-0.4)\;mol=0.6\;\rm mol$;根据$\rm O$原子守恒可知体系内$\rm H_{2}O$的物质的量为$\rm (2-0.4\times 2-1)\;mol=0.2\;\rm mol$;根据$\rm H$原子守恒可知氢气的物质的量为:$\dfrac{4-0.2\times 2-0.6\times 4}{2}\text{ mol}=0.6\;\rm mol$,此时容器内气体的物质的量为:$\rm (1+0.4+0.6+0.2+0.6)\;mol=2.8\;\rm mol$;反应$\rm i$的$ K_{\rm p}=\dfrac{{{{p}}^{2}}\left( \text{CO} \right){{{p}}^{2}}\left( {{\text{H}}_{2}} \right)}{{p}\left( \text{C}{{\text{O}}_{2}} \right){p}\left( \text{C}{{\text{H}}_{4}} \right)}=\dfrac{{{\left( \dfrac{1}{2.8}\times 1.4 \right)}^{2}}\times {{\left( \dfrac{0.6}{2.8}\times 1.4 \right)}^{2}}}{\left( \dfrac{0.4}{2.8}\times 1.4 \right)\times \left( \dfrac{0.6}{2.8}\times 1.4 \right)}=0.375$。
高中 | 化学平衡常数题目答案及解析(完整版)
