高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
氨燃料电池是当前推动绿氨能源化应用的重要研究方向和热点。一种通过光$h\nu -\text{Ni}$:$\text{Ti}{{\text{O}}_{2}}$催化合成绿氨联合氨燃料电池的装置如图,在光照作用下光催化剂被激发产生电子$\left( {{\text{e}}^{-}} \right)$和空穴$\left( {{\text{h}}^{+}} \right)$。下列说法错误的是$(\quad\ \ \ \ )$
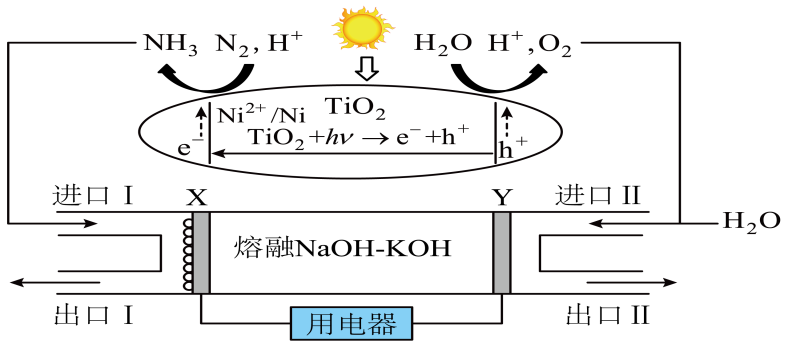
$\\text{X}$极电势低于$\\text{Y}$极电势
","光催化剂表面发生反应:$2{{\\text{H}}_{2}}\\text{O}+4{{\\text{h}}^{+}}=4{{\\text{H}}^{+}}+{{\\text{O}}_{2}}$
","$\\text{X}$极的电极反应式是$2\\text{N}{{\\text{H}}_{3}}+6\\text{O}{{\\text{H}}^{-}}-6{{\\text{e}}^{-}}={{\\text{N}}_{2}}+6{{\\text{H}}_{2}}\\text{O}$
","燃料电池中,$\\rm OH^{-}$向$\\rm Y$电极移动
"]$\rm N_{2}$在光催化剂表面转化为$\rm NH_{3}$,碱性介质条件下,$\rm NH_{3}$转化为$\rm N_{2}$,化合价,发生氧化反应,则电极$\rm X$为负极,电极反应式为:$2\text{N}{{\text{H}}_{3}}+6\text{O}{{\text{H}}^{-}}-6{{\text{e}}^{-}}={{\text{N}}_{2}}+6{{\text{H}}_{2}}\text{O}$;$\rm H_{2}O$转化为$\rm O_{2}$,化合价降低,发生还原反应,则电极$\rm Y$为正极,电极反应式为:$\rm 2H_{2}O+4e^{-}=H_{2}+4OH^{-}$,据此分析回答。
$\rm A$.由分析可知,电极$\rm X$为负极,电极$\rm Y$为正极,则$\rm X$极电势低于$\rm Y$极电势,$\rm A$正确;
$\rm B$.光催化剂表面$\rm H_{2}O$转化为$\rm O_{2}$,发生反应为:$2{{\text{H}}_{2}}\text{O}+4{{\text{h}}^{+}}=4{{\text{H}}^{+}}+{{\text{O}}_{2}}$,$\rm B$正确;
$\rm C$.电极$\rm X$为负极,电极反应式为:$2\text{N}{{\text{H}}_{3}}+6\text{O}{{\text{H}}^{-}}-6{{\text{e}}^{-}}={{\text{N}}_{2}}+6{{\text{H}}_{2}}\text{O}$,$\rm C$正确;
$\rm D$.由分析可知,电极$\rm X$为负极,电极$\rm Y$为正极,原电池中阴离子向负极移动,则$\rm OH^{-}$向$\rm X$电极移动,$\rm D$错误;
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
