高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\rm 2023$年杭州亚运会主火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内的零排放。“零碳甲醇”作为公认的新型清洁可再生能源,不易爆炸,储运安全便捷。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)+{{H}_{2}}O(g) }\quad\Delta H_1=-49.4 \ \rm {kJ} / {mol}$
②${\rm C{{O}_{2}}(g)+{{H}_{2}}(g)\rightleftharpoons CO(g)+{{H}_{2}}O(g)}\quad\Delta{{H}_{2}}=+41\rm \ kJ/mol$
③${\rm CO(g)+2{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)}\quad\Delta {{H}_{3}}$
已知:甲醇的选择性$=\dfrac{n{\rm (甲醇)}}{n( 参加反应的C{{O}_{2}})}$
$\Delta {{H}_{3}}=$ $\rm kJ/mol$,该反应自发进行的条件是 $\rm ($填“高温”、“低温”、“任意温度”$\rm )$。
$\\rm -90.4$;低温
"]]根据盖斯定律,①$\rm -$②$\rm =$③,故$\Delta {{H}_{3}}=\Delta {{H}_{1}}-\Delta {{H}_{2}}=(-49.4\rm \ kJ/mol)-(+41\ kJ/mol)=-90.4\ kJ/mol$;反应③为$\Delta H\lt 0$、$\Delta S\lt 0$,则低温条件满足$\Delta G= \Delta H-T\cdot \Delta S\lt 0$反应自发可以进行。
一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中$\dfrac{n{\rm (C{{H}_{3}}OH)}}{n{\rm (CO)}}$增大且加快化学反应速率的是___________$\rm ($填字母$\rm )$。
$\rm A$.升高温度
$\rm B$.充入$\rm He(g)$,使体系压强增大
$\rm C$.再充入$\rm 1\ mol\ {{H}_{2}}$
$\rm D$.将$\rm {{H}_{2}}O(g)$从体系中分离出去
$\\rm C$
"]]反应③${\rm CO(g)+2{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)}\quad\Delta {{H}_{3}}\lt 0$,$\rm A$.升高温度,反应速率加快,平衡逆移,${n}\rm \left({CH}_{3} {OH}\right)$减小、$n{\rm (CO)}$增大,$\dfrac{n\rm \left(C H_{3} O H\right)}{n{\rm (C O)}}$减小,$\rm A$项错误。
$\rm B$.充入$\rm He(g)$,使体系压强增大,则体积未发生变化,各物质浓度不变,反应速率不变,平衡不移动,$\dfrac{n\rm \left(C H_{3} O H\right)}{n{\rm (C O)}}$不变,$\rm B$项错误。
$\rm C$.再充入$\rm 1\ mol\ {{H}_{2}}$,$c{\rm ({{H}_{2}})}$增大,反应速率加快,平衡正移,${n}\rm \left({CH}_{3} {OH}\right)$增大、$n{\rm (CO)}$减小,$\dfrac{n\rm \left(C H_{3} O H\right)}{n{\rm (C O)}}$增大,$\rm C$项正确。
$\rm D$.将$\rm {{H}_{2}}O(g)$从体系中分离出去,$c{\rm ({{H}_{2}}O)}$减小,使各物质的反应速率减慢,$\rm D$项错误。
恒温恒容条件下,原料气$\rm C{{O}_{2}}(g)$、$\rm {H}_{2}({g})$以物质的量浓度之比为$\rm 1:3$投料时,控制合适条件$\rm ($不考虑反应③$\rm )$,甲醇的选择性为$\rm 60\%$。已知初始压强为$\rm 4\ MPa$,$c{\rm (C{{O}_{2}})}=1.0\rm \ mol/L$,达到平衡时,$c{\rm (C O)}=0.2\ \rm m o l / L$,则该过程中$\rm C{{O}_{2}}$的平衡转化率为 $\%$,该条件下反应②的${{K}_{\rm p}}=$ $\rm ($保留三位有效数字$\rm )$。
$\\rm 50\\%$;$\\rm 0.105$
"]]恒温恒容条件下,已知初始压强为$\rm 4\ MPa$,设容器体积为$V$,原料气$\rm C{{O}_{2}}(g)$、$\rm {H}_{2}({g})$以物质的量浓度之比为$\rm 1:3$投料时,$c{\rm (C{{O}_{2}})}=1.0\rm \ mol/L$,$c{\rm ({{H}_{2}})}=3.0\rm \ mol/L$,达到平衡时,$c{\rm (C O)}=0.2 \ \rm m o l / L$,设甲醇的浓度为$x\ \rm mol/L$,利用三段式分析$\rm \begin{matrix} {} & \rm C{{O}_{2}}(g) & +\rm 3{{H}_{2}}(g) & \rightleftharpoons & \rm C{{H}_{3}}OH(g) & \rm +{{H}_{2}}O(g) \\ 初始\rm mol/L & 1.0 & 3.0 & {} & 0 & 0 \\ 转化\rm mol/L & x & 3x & {} & x & x \\ 平衡\rm mol/L & {} & {} & {} & x & {} \\ \end{matrix}$
$\rm \begin{matrix} {} & \rm C{{O}_{2}}(g) & +\rm {{H}_{2}}(g) & \rightleftharpoons & \rm CO(g) & \rm +{{H}_{2}}O(g) \\ 初始\rm (mol/L) & {} & {} & {} & 0 & x \\ 转化\rm (mol/L) & 0.2 & 0.2 & {} & 0.2 & 0.2 \\ 平衡\rm (mol/L) & 1.0-x-0.2 & 3.0-3x-0.2 & {} & 0.2 & x+0.2 \\ \end{matrix}$,则根据平衡时甲醇的选择性为$60\%=\dfrac{x\cdot V}{x\cdot V+0.2V}$,解得$x=0.3\rm \ mol/L$,该过程中$\rm C{{O}_{2}}$的平衡转化率为$\rm \dfrac{0.3+0.2}{1.0}\times 100\%=50\%$;平衡时,$c{\rm (C{{O}_{2}})}=(1.0-0.3-0.2)\ \rm mol/L=0.5\ mol/L$,$c{\rm ({{H}_{2}})}=(3.0-3\times 0.3-0.2)\ \rm mol/L=1.9\ mol/L$,$c{\rm (C{{H}_{3}}OH)}=0.3\rm \ mol/L$,$c{\rm ({{H}_{2}}O)}=(0.3+0.2)\ \rm mol/L=0.5\ mol/L$,$c{\rm (C O)}=0.2\ \rm m o l / L$,总浓度为$\rm 3.4\ mol/L$,根据恒温恒压条件,$\dfrac{p{\rm (初)}}{p(平)}=\dfrac{n{\rm (初)}}{n(平)}$,$p{\rm (平)}=\dfrac{p(初)n{\rm (平)}}{n(初)}=\dfrac{4\ {\rm MPa}\times 3.4{\rm \ mol/L}\cdot V}{1.0{\rm \ mol/L}\cdot V+3.0{\rm \ mol/L}\cdot V}=3.4\rm \ MPa$,该条件下反应②的${{K}_{\rm p}}=\dfrac{p{\rm (CO)}\cdot p{\rm ({{H}_{2}}O)}}{p{\rm (C{{O}_{2}})}\cdot p{\rm ({{H}_{2}})}}=\rm \dfrac{\left[ 3.4\ MPa\times \dfrac{0.2\ mol/L}{3.4\ mol/L} \right]\times \left[ 3.4\ MPa\times \dfrac{0.5\ mol/L}{3.4\ mol/L} \right]}{\left[ 3.4\ MPa\times \dfrac{0.5\ mol/L}{3.4\ mol/L} \right]\times \left[ 3.4\ MPa\times \dfrac{1.9\ mol/L}{3.4\ mol/L} \right]}\approx 0.105$。
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原$\rm C{{O}_{2}}$制备甲醇的装置如左图所示。控制其他条件相同,将一定量的$\rm C{{O}_{2}}$通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右图所示。
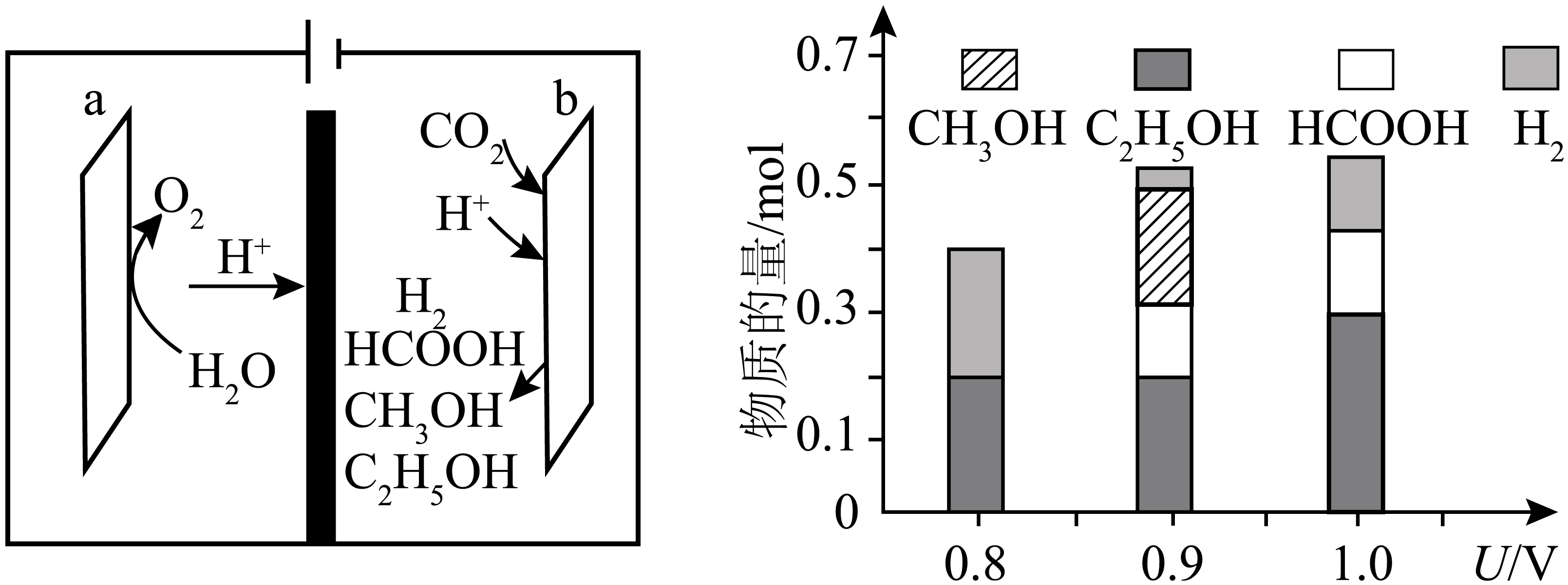
电极生成$\rm C{{H}_{3}}OH$的电极反应式为 。
$\\rm C{{O}_{2}}+6{{e}^{-}}+6{{H}^{+}}=C{{H}_{3}}OH+{{H}_{2}}O$
"]]还原$\rm C{{O}_{2}}$制备甲醇的装置为电解池,其中生成$\rm C{{H}_{3}}OH$的$\rm b$电极为阴极,电解质溶液中的$\rm {{H}^{+}}$参加反应,反应式为$\rm C{{O}_{2}}+6{{e}^{-}}+6{{H}^{+}}=C{{H}_{3}}OH+{{H}_{2}}O$。
控制电压为$\rm 0.8\ V$,电解时转移电子的物质的量为 $\rm \ mol$
$\\rm 2.8$
"]]根据阴极所得产物及其物质的量与电压的关系图可知,控制电压为$\rm 0.8\ V$,生成$\rm C{{H}_{3}}C{{H}_{2}}OH$物质的量$\rm 0.2\ mol$、生成$\rm {{H}_{2}}$物质的量$\rm 0.2\ mol$,根据电极反应式$\rm 2C{{O}_{2}}+12{{e}^{-}}+12{{H}^{+}}=C{{H}_{3}}C{{H}_{2}}OH+3{{H}_{2}}O$、$\rm 2{{H}^{+}}+2{{e}^{-}}={{H}_{2}}\uparrow $,则转移电子的物质的量为$\rm 0.2\ mol\times 12+0.2\ mol\times 2=2.8\ mol$。
Ⅲ.甲烷催化氧化法
主反应:$\rm 2C{{H}_{4}}(g)+{{O}_{2}}(g)\rightleftharpoons 2C{{H}_{3}}OH(g)$
副反应:$\rm C{{H}_{4}}(g)+2{{O}_{2}}(g)\rightleftharpoons C{{O}_{2}}(g)+2{{H}_{2}}O(g)$
科学家将$\rm C{{H}_{4}}$、$\rm {{O}_{2}}$和$\rm {{H}_{2}}O(g)({{H}_{2}}O$是活性催化剂$\rm )$按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示$\rm ($吸附在催化剂表面的物种用*标注,$\rm TS$代表过渡态$\rm )$。
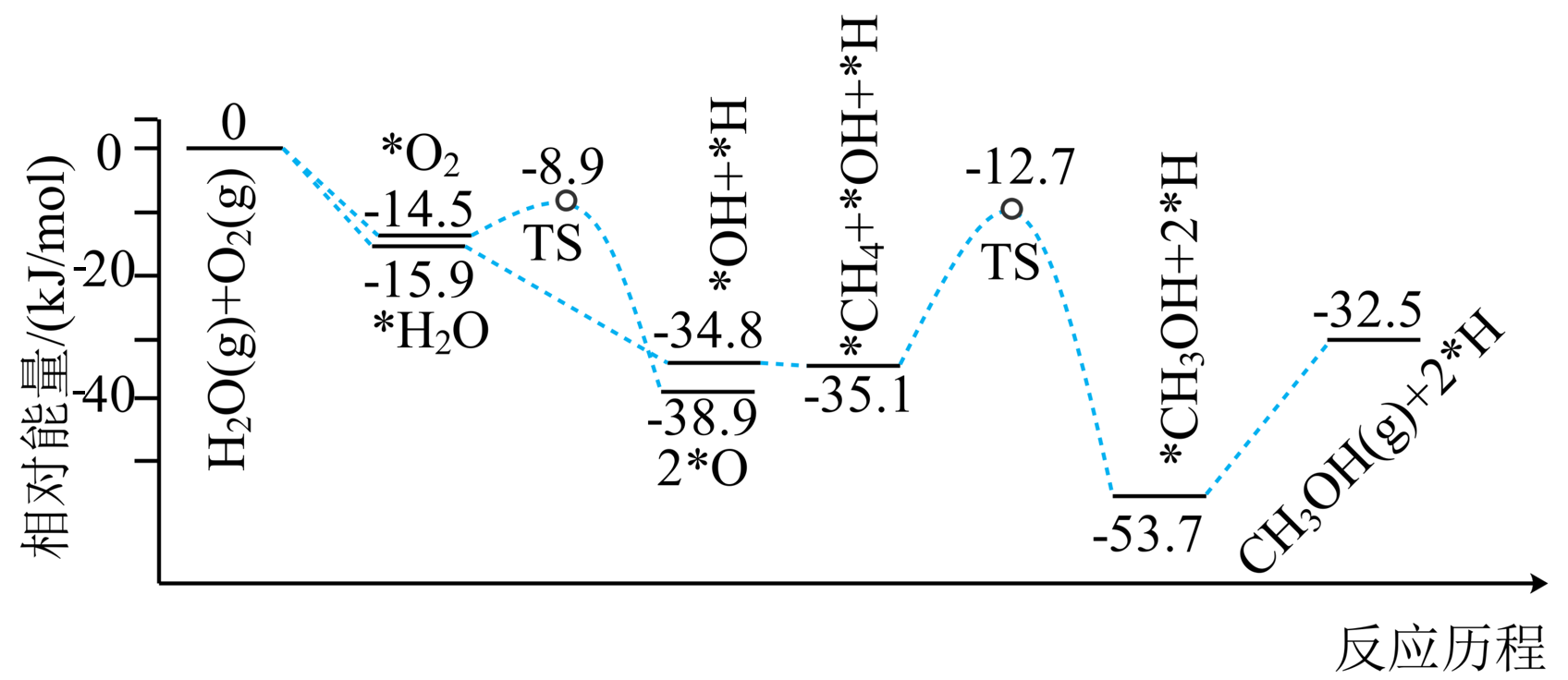
该历程中决速步的化学方程式: 。
$\\rm ^{*}C{{H}_{4}}{{+}^{*}}OH{{\\rightleftharpoons }^{*}}C{{H}_{3}}OH{{+}^{*}}H$或$\\rm ^{*}C{{H}_{4}}{{+}^{*}}OH{{+}^{*}}H{{\\rightleftharpoons }^{*}}C{{H}_{3}}OH+{{2}^{*}}H$
"]]决速步的活化能最大,由图可知$\rm ^{*}C{{H}_{4}}+{^{*}}OH+{^{*}}H$转化为$\rm ^{*}C{{H}_{3}}OH+{{2}^{*}}H$的过程,活化能为$\rm (-12.7\ kJ/mol)-(-35.1\ kJ/mol)=22.4\ kJ/mol$最大,该步化学方程式为$\rm ^{*}C{{H}_{4}}+{^{*}}OH{{\rightleftharpoons }^{*}}C{{H}_{3}}OH+{^{*}}H$或$\rm ^{*}C{{H}_{4}}+{^{*}}OH+{^{*}}H{{\rightleftharpoons }^{*}}C{{H}_{3}}OH+{{2}^{*}}H$。
高中 | 化学平衡常数题目答案及解析(完整版)
