高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
某二次电池充电时的原理如图所示,该过程可实现盐溶液的淡化。下列叙述正确的是$(\quad\ \ \ \ )$
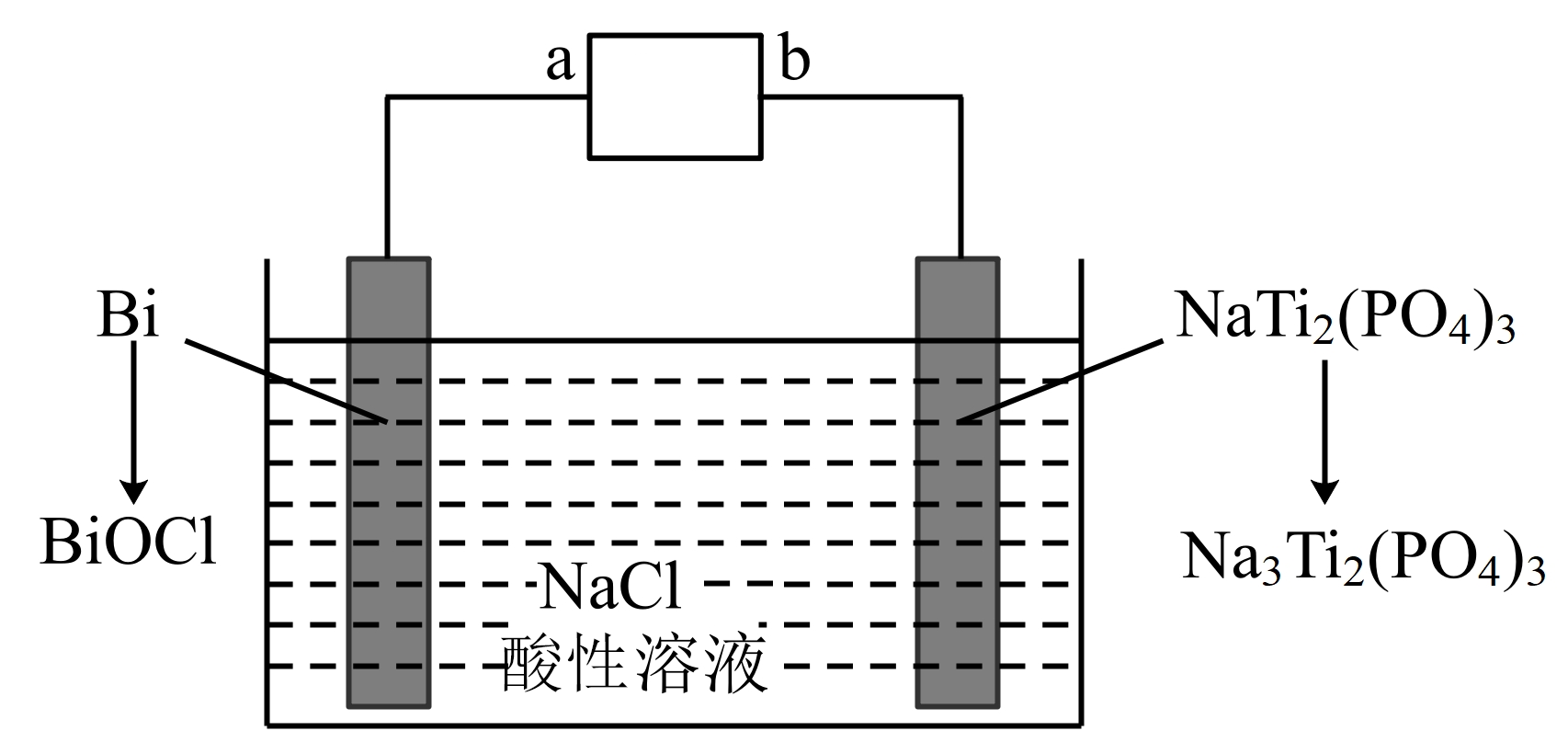
充电时,$\\rm a$为电源正极
","放电时,$\\text{N}{{\\text{a}}^{+}}$向$\\text{NaT}{{\\text{i}}_{2}}{{\\left( \\text{P}{{\\text{O}}_{4}} \\right)}_{3}}/\\text{N}{{\\text{a}}_{3}}\\text{T}{{\\text{i}}_{2}}{{\\left( \\text{P}{{\\text{O}}_{4}} \\right)}_{3}}$电极移动
","充电时,两电极新增加的物质中:$n\\left( \\text{N}{{\\text{a}}^{+}} \\right)=n\\left( \\text{C}{{\\text{l}}^{-}} \\right)$
","放电时,负极的电极反应为:$\\text{Bi}-3{{\\text{e}}^{+}}+\\text{C}{{\\text{l}}^{-}}+{{\\text{H}}_{2}}\\text{O}=\\text{BiOCl}+2{{\\text{H}}^{+}}$
"]充电时,$\rm Bi$电极上,$\rm Bi$失电子生成$\rm BiOCl$,反应为$\rm Bi+Cl^{-}+H_{2}O-3e^{-}=BiOCl+2H^{+}$,则$\rm Bi$为阳极,所以$\rm a$ 为电源正极,$\rm b$为负极,$\rm NaTi_{2}(PO_{4})_{3}$得电子发生还原反应,为阴极,电极反应为$\rm NaTi_{2}(PO_{4})_{3}+2Na^{+}+2e^{-}=Na_{3}Ti_{2}(PO_{4})_{3}$,放电时,$\rm Bi$为正极,$\rm BiOCl$得电子发生还原反应,$\rm NaTi_{2}(PO_{4})_{3}$为负极。
$\rm A$.充电时,$\rm Bi$电极上,$\rm Bi$失电子生成$\rm BiOCl$,$\rm Bi$为阳极,则$\rm a$为电源正极,$\rm A$正确;
$\rm B$.放电时,该装置做原电池,原电池中阳离子向正极移动,$\rm Bi$为正极,则$\text{N}{{\text{a}}^{+}}$向$\text{Bi/BiOCl}$电极移动,$\rm B$错误;
$\rm C$.充电时,$\rm Bi$电极上,电极反应为$\rm Bi+Cl^{-}+H_{2}O-3e^{-}=BiOCl+2H^{+}$,$\rm NaTi_{2}(PO_{4})_{3}$电极上,电极反应为$\rm NaTi_{2}(PO_{4})_{3}+2Na^{+}+2e^{-}=Na_{3}Ti_{2}(PO_{4})_{3}$,所以新增入电极中的物质:$n(\rm Na^{+})$∶$n(\rm Cl^{- })=3$∶$\rm 1$,$\rm C$错误;
$\rm D$.放电时,负极的反应与电解池阴极的反应相反,电极反应为:$\rm Na_{3}Ti_{2}(PO_{4})_{3}-2e^{-}=NaTi_{2}(PO_{4})_{3}+2Na^{+}$,$\rm D$错误;
故选:$\rm A$
高中 | 原电池工作原理题目答案及解析(完整版)
