高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
绿氨作为“零碳”燃料,是未来重要的清洁能源。
氨燃料的应用。$\text{N}{{\text{H}}_{3}}$和${{\text{H}}_{2}}$混合燃烧可改善$\text{N}{{\text{H}}_{3}}$的燃烧性能,在$\rm 25\;\rm ^\circ\rm C$和$\rm 101\;\rm kPa$下:
ⅰ$.2{{\text{H}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\qquad\Delta {{H}_{1}}=-571.6\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
ⅱ$.{{\text{N}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2\text{NO}\left( \text{g} \right)\qquad\Delta {{H}_{2}}=+182.6\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
ⅲ$.4\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+5{{\text{O}}_{2}}\left( \text{g} \right)=4\text{NO}\left( \text{g} \right)+6{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\qquad\Delta {{H}_{3}}=-1164.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
①该条件下,$\text{N}{{\text{H}}_{3}}$的燃烧热$\Delta H=$ 。
②在绝热容器中,将一定体积、不同组成比的$\text{N}{{\text{H}}_{3}}$、${{\text{H}}_{2}}$混合气体在足量${{\text{O}}_{2}}$中燃烧,其他条件相同时,测得体系的最高温度和反应后$\rm NO$的物质的量分数随${{\text{H}}_{2}}$含量的变化如图所示(反应后近平衡状态)。$\rm NO$的物质的量分数随${{\text{H}}_{2}}$含量先增大后减小的原因是 。
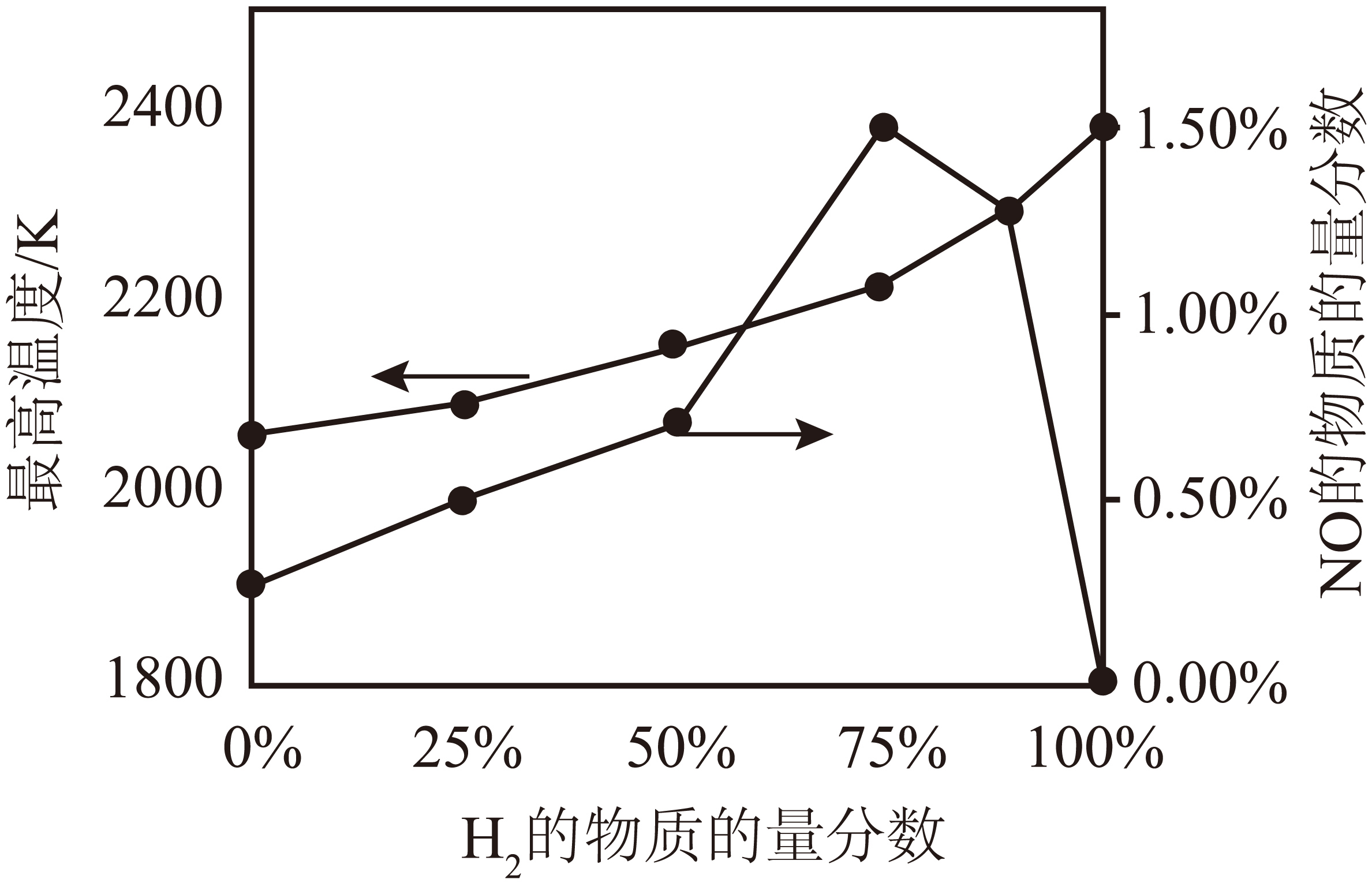
$\\rm -382.5\\;\\rm kJ/mol$;在绝热容器中,反应前后能量守恒,开始时$\\rm H_{2}$含量增加,反应放出的热量增多,温度升高,随着$\\rm H_{2}$含量的继续增加,$\\rm NO$的物质的量分数先增大,随着温度的升高,反应ⅲ平衡逆向移动,从而导致$\\rm NO$的物质的量分数减小
"]]①由ⅱ$.{{\text{N}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2\text{NO}\left( \text{g} \right)\qquad\Delta {{H}_{2}}=+182.6\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,ⅲ$.4\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+5{{\text{O}}_{2}}\left( \text{g} \right)=4\text{NO}\left( \text{g} \right)+6{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\qquad\Delta {{H}_{3}}=-1164.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
根据盖斯定律ⅲ$\rm -2\times $ⅱ得$4\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+3{{\text{O}}_{2}}\left( \text{g} \right)=2{{\text{N}}_{\text{2}}}\left( \text{g} \right)+6{{\text{H}}_{2}}\text{O}\left( \text{l} \right)$$\qquad\Delta H=-1164.8\;\rm kJ/mol-2\times \rm 182.6\;\rm kJ/mol=-1530\;\rm kJ/mol$;
燃烧热是指$\rm 1\;\rm mol$纯物质完全燃烧生成稳定物质时所放出的热量。则该条件下,$\text{N}{{\text{H}}_{3}}$的燃烧热$\Delta H=-1530\;\rm kJ/mol\times \dfrac{1}{4}\rm =-382.5\;\rm kJ/mol$;
②在绝热容器中,反应前后能量守恒,开始时$\rm H_{2}$含量增加,反应放出的热量增多,温度升高;随着$\rm H_{2}$含量的继续增加,$\rm NO$的物质的量分数先增大;随着温度的升高,反应ⅲ平衡逆向移动,从而导致$\rm NO$的物质的量分数减小,所以$\rm NO$的物质的量分数随${{\text{H}}_{2}}$含量先增大后减小。
氨的催化分解。$\text{L}{{\text{i}}_{3}}\text{Fe}{{\text{N}}_{2}}$催化氨分解反应的原理如图所示。
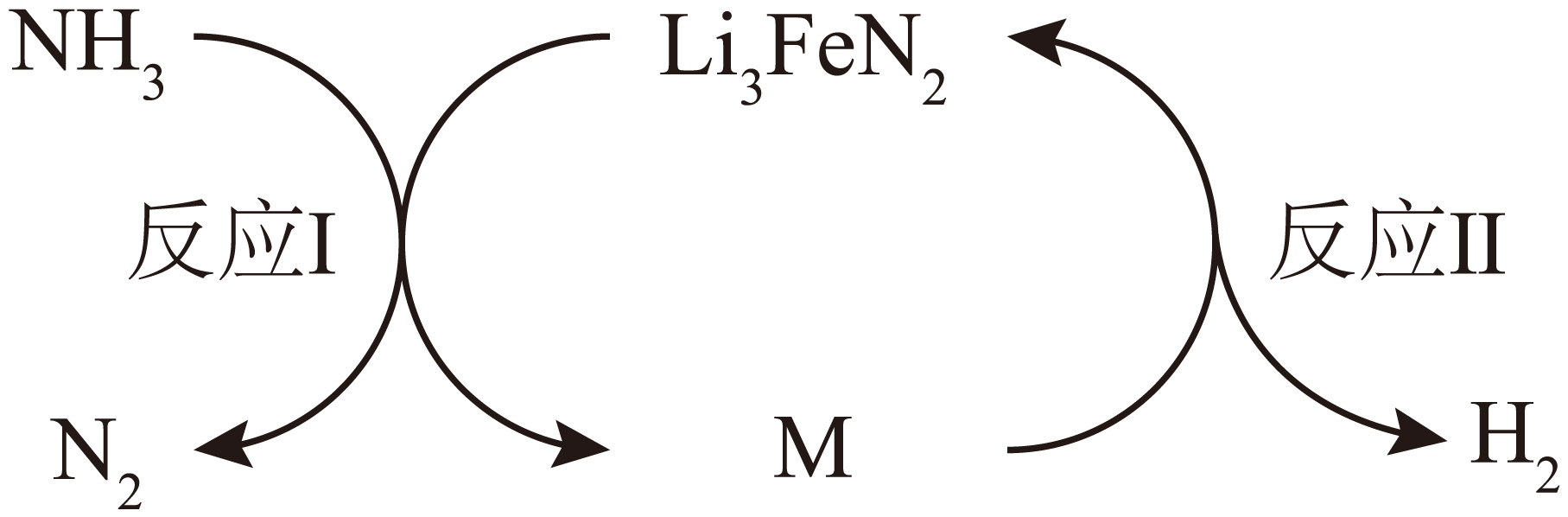
①在$\rm 500\ K$完成反应Ⅰ后,用$\rm X-$射线衍射法判断残留固体$\rm M$的组成,其$\rm X-$射线衍射图如下图中$\rm (a)$所示,该反应的化学方程式为 。
②在$\rm 723\ K$完成反应Ⅱ后,残留固体的$\rm X-$射线衍射图如下图中$\rm (b)$所示,单质$\rm Fe$由$\rm M$中的某物质分解生成。经该循环得到的${{\text{H}}_{2}}$与${{\text{N}}_{2}}$的物质的量之比$\dfrac{n\left( {{\text{H}}_{2}} \right)}{n\left( {{\text{N}}_{2}} \right)}$ $\rm 3$(填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”)。
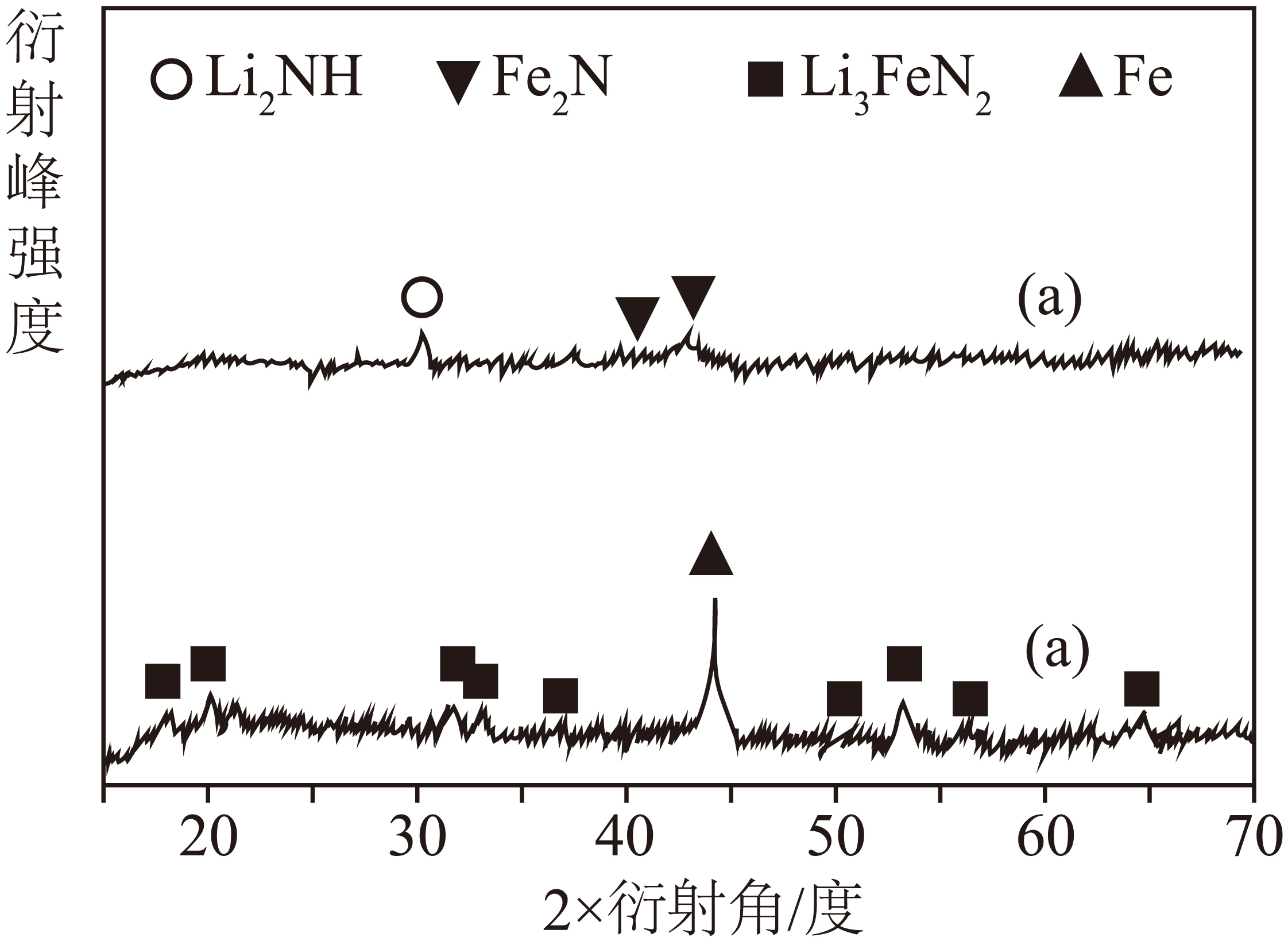
$\\rm 6NH_{3}+$ $\\rm 2\\rm Li_{3}FeN_{2}=Fe_{2}N$ $\\rm +3\\rm L\\rm i_{2}NH+3N_{2}+9H_2$ ;$\\rm \\lt $
"]]①根据$\rm X$射线衍射图$\rm (a)$可知残留固体$\rm M$为$\rm Fe_{2}N$和$\rm Li_{2}NH$,则反应Ⅰ的化学方程式为:$\rm 6NH_{3}+$ $\rm 2\rm Li_{3}FeN_{2}=Fe_{2}N$ $\rm +3\rm Li_{2}NH+3N_{2}+9H_{2}$;
②在$\rm 723\ K$完成反应Ⅱ后,单质$\rm Fe$由$\rm M$中的某物质分解生成。根据含铁物质的化学式,可知$\rm Fe_{2}N$分解放出氮气,所以经该循环得到的${{\text{H}}_{2}}$与${{\text{N}}_{2}}$的物质的量之比$\dfrac{n\left(\mathrm{H}_2\right)}{n\left(\mathrm{ N}_2\right)}\rm \lt 3$。
氨电解反应$2\text{N}\text{H}_{3}\begin{matrix}\underline{\underline{ 电解}}\\\\\end{matrix}\text{N}_{2}\uparrow+3\text{H}_{2}\uparrow$可用于制氢。相同条件下,饱和氨水($\text{N}{{\text{H}}_{3}}$的质量分数为$\rm 34\%$)的密度为$0.90\ \text{g}\cdot\text{c}\text{m}^{-3}$,液氨的密度为$0.77\ \text{g}\cdot\text{c}\text{m}^{-3}$。
①电解含$\text{KN}{{\text{H}}_{2}}$的液氨溶液制${{\text{H}}_{2}}$的装置如图所示,电解时,阳极的电极反应式为 。

②氨气燃料的性能可用“能量密度”来衡量,能量密度$=\dfrac{电解\text{N}\text{H}_{3}可释放出\text{H}_{2}的物质的量\left( \text{mol}\right)}{氨水或液氨的体积\left( \text{L}\right)}$,则饱和氨水的能量密度为 (写出计算过程)。
③相比电解饱和氨水,电解液氨法制${{\text{H}}_{2}}$的优点是 。
$\\text{6NH}_{2}^{-}-6{{\\text{e}}^{-}}={{\\text{N}}_{2}}\\uparrow +4\\text{N}{{\\text{H}}_{\\text{3}}}$ ;$\\rm 27\\;\\rm mol/L$ ;“能量密度”大
"]]①电解含$\text{KN}{{\text{H}}_{2}}$的液氨溶液制${{\text{H}}_{2}}$的装置如图所示,电解时,$\mathrm{NH}_2^{-}$ 在阳极失电子生成$\rm N_{2}$,阳极的电极反应式为$\text{6NH}_{2}^{-}-6{{\text{e}}^{-}}={{\text{N}}_{2}}\uparrow +4\text{N}{{\text{H}}_{\text{3}}}$。
②设饱和氨水的体积为$\rm 1\;\rm L$,密度为$0.90\ \text{g}\cdot\text{c}\text{m}^{-3}$,则氨水的质量为$\rm 900\;\rm g$,$n\rm (NH_{3})=\dfrac{\text{900\;\rm g}\times \text{34 }\!\!\%}{\text{17\;\rm g/mol}}=18\;\rm \text{mol}$,氨电解反应$2\text{N}\text{H}_{3}\begin{matrix}\underline{\underline{ 电解}}\\\\\end{matrix}\text{N}_{2}\uparrow+3\text{H}_{2}\uparrow$,则放出氢气的物质的量为$\rm 27\;\rm mol$,则饱和氨水的能量密度为$\rm 27\;\rm mol/L$。
③设液氨的体积为$\rm 1\;\rm L$,液氨的密度为$0.77\ \text{g}\cdot\text{c}\text{m}^{-3}$,则液氨的质量为$\rm 770\;\rm g$,$n\rm (NH_{3})=\dfrac{\text{770\;\rm g}}{\text{17\;\rm g/mol}}=45.3\;\rm \text{mol}$,氨电解反应$2\text{N}\text{H}_{3}\begin{matrix}\underline{\underline{ 电解}}\\\\\end{matrix}\text{N}_{2}\uparrow+3\text{H}_{2}\uparrow$,则放出氢气的物质的量为$\rm 68\;\rm mol$,则液氨的能量密度为$\rm 68\;\rm mol/L$,相比电解饱和氨水,电解液氨法制${{\text{H}}_{2}}$的优点是“能量密度”大。
高中 | 盖斯定律题目答案及解析(完整版)
