高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
$\text{B}{{\text{r}}_{2}}$具有较强的氧化性,能够将磷氧化为$\text{PB}{{\text{r}}_{3}}$或$\text{PB}{{\text{r}}_{5}}\rm (\text{PB}{{\text{r}}_{5}}$可以水解得到两种酸$\rm )$,与氨反应生成溴化铵和氮气,可以氧化一些非金属阴离子,如$\text{B}{{\text{r}}_{2}}$与${{\text{S}}^{2-}}$反应生成${{\text{S}}_{8}}\rm ($ $\rm )$。在催化剂作用下,苯与$\text{B}{{\text{r}}_{2}}$发生取代反应,该反应属于放热反应。醛与$\text{B}{{\text{r}}_{2}}$在碱的催化下,醛的$\alpha-$氢被溴取代生成$\alpha-$溴代醛。工业上海水提溴的主要过程为:
$\rm )$。在催化剂作用下,苯与$\text{B}{{\text{r}}_{2}}$发生取代反应,该反应属于放热反应。醛与$\text{B}{{\text{r}}_{2}}$在碱的催化下,醛的$\alpha-$氢被溴取代生成$\alpha-$溴代醛。工业上海水提溴的主要过程为: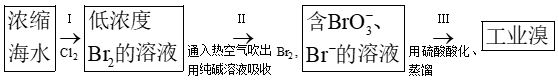
下列说法正确的是$(\quad\ \ \ \ )$
基态溴原子的电子排布式为$[\\text{Ar}]4{{\\text{s}}^{2}}4{{\\text{p}}^{5}}$
","$\\text{PB}{{\\text{r}}_{3}}$中$\\rm P$原子的轨道杂化类型为$\\text{s}{{\\text{p}}^{3}}$杂化
","${{\\text{S}}_{8}}$是由极性键构成的非极性分子
","$\\mathrm{BrO}_{3}^{-}$的空间结构为平面三角形
"]$\rm A$.溴为$\rm 35$号元素,其基态原子电子排布式为$\rm [Ar]3d^{10}4s^{2}4p^{5}$,$\rm A$错误;
$\rm B$.$\rm PBr_{3}$中$\rm P$原子价层电子对数为:$3+\dfrac{1}{2}\left( 5-1\times 3 \right)=4$,则$\rm P$原子的轨道杂化类型为$\rm sp^{3}$杂化,$\rm B$正确;
$\rm C$.由$\rm S_{8}$结构可知,其环状结构对称,正负电荷中心重合,是由非极性键构成的非极性分子,$\rm C$错误;
$\rm D$.$\mathrm{BrO}_{3}^{-}$中$\rm Br$原子价层电子对数为:$3+\dfrac{1}{2}\left( 7+1-2\times 3 \right)=4$,孤电子对数为$\rm 1$,杂化类型为$\rm sp^{3}$杂化,其空间结构为三角锥形,$\rm D$错误;
故选:$\rm B$
高中 | 杂化轨道理论题目答案及解析(完整版)
