高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。
减少碳排放的方法有很多,$\rm CO_{2}$转化成有机化合物可有效实现碳循环,如下反应:
$\rm a$.$\text{6C}\text{O}_{\text{2}}\text{+6}\text{H}_{\text{2}}\text{O}\xrightarrow{ 光合作用}\text{C}_{\text{6}}\text{H}_{\text{12}}\text{O}_{\text{6}}\text{+6}\text{O}_{\text{2}}$
$\rm b$.$\text{C}\text{O}_{\text{2}}\text{+3}\text{H}_{\text{2}}\xrightarrow[加热]{催化剂}\text{C}\text{H}_{\text{3}}\text{OH+}\text{H}_{\text{2}}\text{O}$
$\rm c$.$\text{2C}\text{O}_{\text{2}}\text{+6}\text{H}_{\text{2}}\xrightarrow[加热]{催化剂}\text{C}\text{H}_{\text{2}}\text{=C}\text{H}_{\text{2}}\text{+4}\text{H}_{\text{2}}\text{O}$
上述反应中原子利用率最高的是 $\rm ($填编号$\rm )$。
$\\rm b$
"]]由反应可知,$\rm abc$原子利用率分别为$\dfrac{180}{372}\times 100\%\approx 48.3\%$、$\dfrac{32}{50}\times 100\%=64\%$、$\dfrac{28}{100}\times 100\%\text{=2}8\%\!\!\text{ }$,则上述反应中原子利用率最高的是$\rm b$;
$\text{C}{{\text{O}}_{2}}$在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:$\text{C}\text{O}_{\text{2}}\text{(g)+4}\text{H}_{\text{2}}\text{(g)}\rightleftharpoons\text{C}\text{H}_{\text{4}}\text{(g)+2}\text{H}_{\text{2}}\text{O(g)}\qquad\Delta\textit{H}_{\text{1}}=-\text{156}\text{.9\ kJ}\cdot\text{mo}\text{l}^{\text{-1}}$
副反应:$\text{C}\text{O}_{\text{2}}\text{(g)+}\text{H}_{\text{2}}\text{(g)}\rightleftharpoons \text{CO(g)+}\text{H}_{\text{2}}\text{O(g)}\qquad \Delta\textit{H}_{\text{2}}\text{=+41}\text{.1\ kJ}\cdot\text{mo}\text{l}^{\text{-1}}$
已知:$\text{2}\text{H}_{\text{2}}\text{(g)+}\text{O}_{\text{2}}\text{(g)=2}\text{H}_{\text{2}}\text{O(g)}\qquad \Delta\textit{H}_{\text{3}}=-\text{395}\text{.6\ kJ}\cdot\text{mo}\text{l}^{\text{-1}}$,
则$\text{C}{{\text{H}}_{\text{4}}}$燃烧的热化学方程式$\text{C}{{\text{H}}_{\text{4}}}\text{(g)+2}{{\text{O}}_{\text{2}}}\text{(g)=C}{{\text{O}}_{\text{2}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\qquad\Delta\!\!\textit{ H}=$ 。
$\\text{-634}\\text{.3\\ kJ}\\cdot\\text{mo}\\text{l}^{\\text{-1}}$
"]]已知:
①$\text{2}\text{H}_{\text{2}}\text{(g)+}\text{O}_{\text{2}}\text{(g)=2}\text{H}_{\text{2}}\text{O(g)}\qquad \Delta\textit{H}_{\text{3}}=-\text{395}\text{.6\ kJ}\cdot\text{mo}\text{l}^{\text{-1}}$
②$\text{C}\text{O}_{\text{2}}\text{(g)+4}\text{H}_{\text{2}}\text{(g)}\rightleftharpoons \text{C}\text{H}_{\text{4}}\text{(g)+2}\text{H}_{\text{2}}\text{O(g)}\qquad\Delta\textit{H}_{\text{1}}=-\text{156}\text{.9\ kJ}\cdot\text{mo}\text{l}^{\text{-1}}$
根据盖斯定律可知,①$\rm \times 2-$②得:$\text{C}{{\text{H}}_{\text{4}}}\text{(g)+2}{{\text{O}}_{\text{2}}}\text{(g)=C}{{\text{O}}_{\text{2}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\qquad \text{ }\!\!\Delta\!\!\textit{ H}=-634.3\ \rm kJ\cdot mol^{-1}$;
利用电化学方法通过微生物电催化将$\text{C}{{\text{O}}_{2}}$有效地转化为${{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}$,装置如图$\rm 1$所示。阴极区电极反应式为 ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是 。
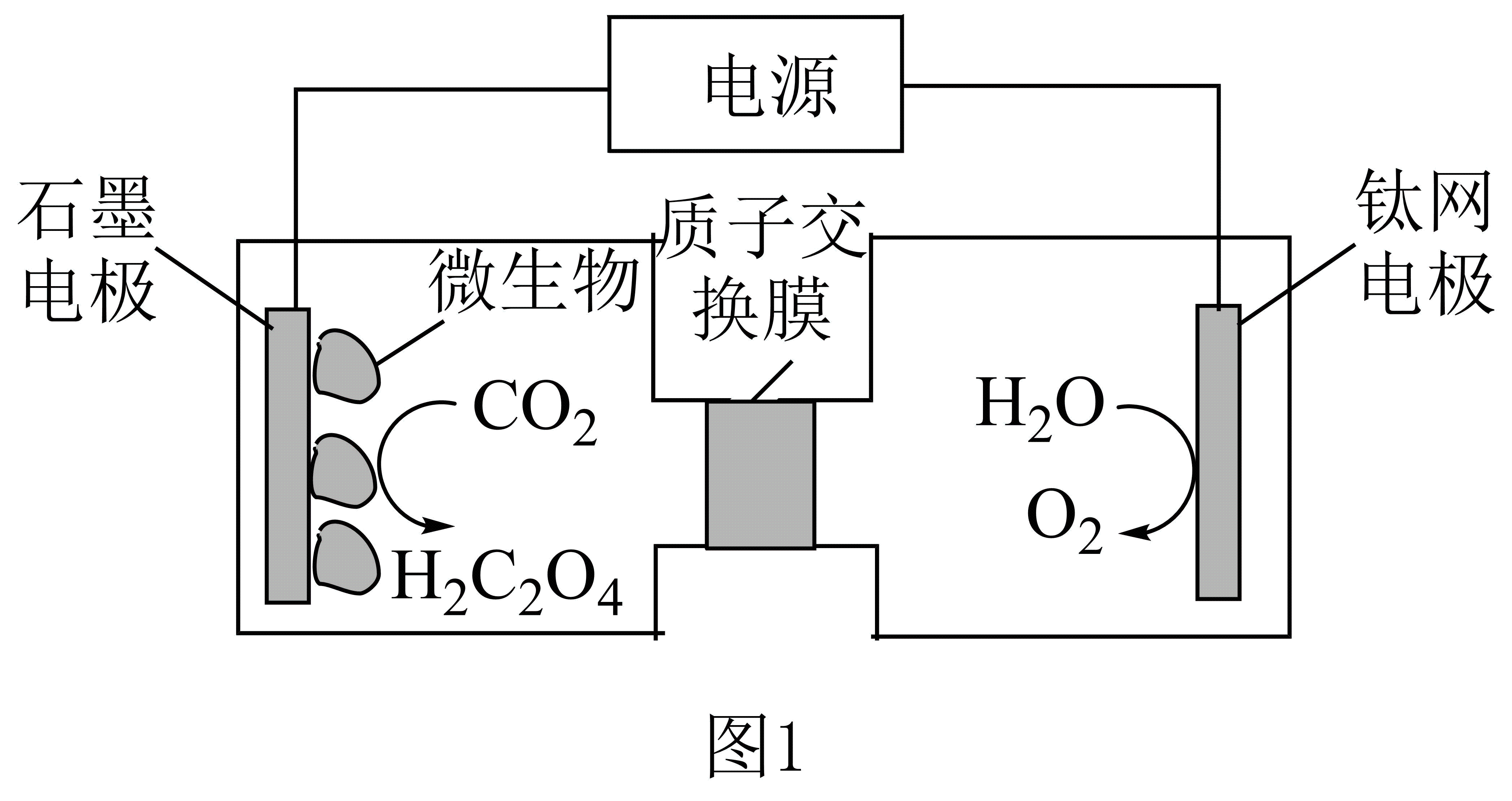
$2\\text{C}{{\\text{O}}_{2}}+2{{\\text{e}}^{-}}+2{{\\text{H}}^{+}}={{\\text{H}}_{2}}{{\\text{C}}_{2}}{{\\text{O}}_{4}}$ ;温度过高微生物催化能力降低或催化剂失活
"]]由图可知,阴极区二氧化碳得到电子发生还原反应生成草酸,反应为$2\text{C}{{\text{O}}_{2}}+2{{\text{e}}^{-}}+2{{\text{H}}^{+}}={{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}$;温度过高微生物催化能力降低或催化剂失活,使得电极反应的速率反而迅速下降;
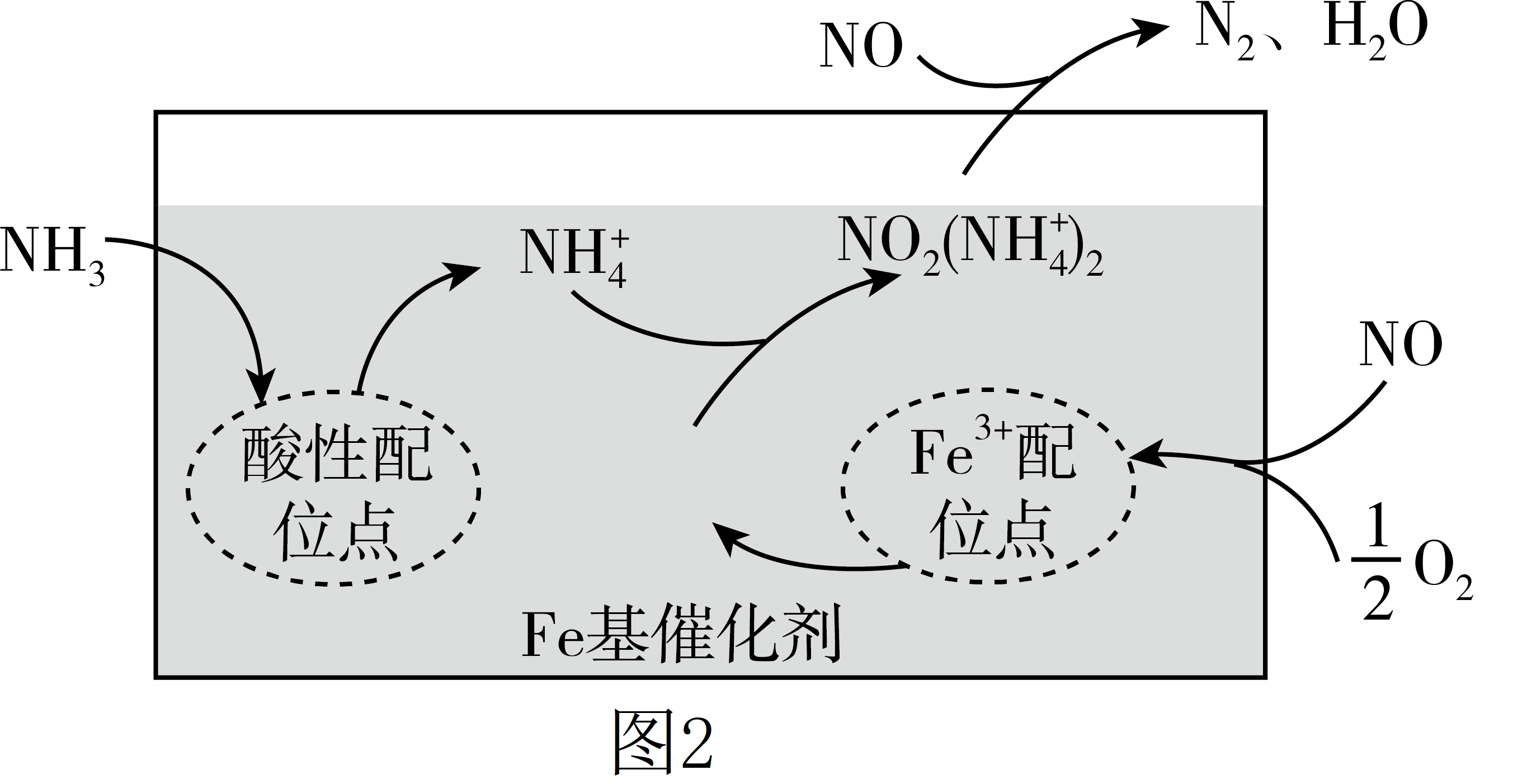
研究脱除烟气中的$\text{NO}$是环境保护、促进社会可持续发展的重要课题。有氧条件下,在$\text{Fe}$基催化剂表面,$\text{N}{{\text{H}}_{\text{3}}}$还原$\text{NO}$的反应机理如图$\rm 2$所示,该过程可描述为 。
在$\\rm Fe$基催化剂表面,$\\text{N}{{\\text{H}}_{\\text{3}}}$吸附在酸性配位点上形成$\\text{NH}_{\\text{4}}^{+}$,$\\text{NO}$与${{\\text{O}}_{\\text{2}}}$吸附在$\\text{F}{{\\text{e}}^{\\text{3+}}}$配位点上形成$\\text{N}{{\\text{O}}_{\\text{2}}}$,然后$\\text{NH}_{\\text{4}}^{+}$与$\\text{N}{{\\text{O}}_{\\text{2}}}$结合生成$\\text{N}{{\\text{O}}_{\\text{2}}}{{\\left( \\text{NH}_{\\text{4}}^{+} \\right)}_{\\text{2}}}$,最后$\\text{N}{{\\text{O}}_{\\text{2}}}{{\\left( \\text{NH}_{\\text{4}}^{+} \\right)}_{\\text{2}}}$与$\\text{NO}$反应生成$\\text{N}_{\\text{2}},\\text{H}_{\\text{2}}\\text{O}$,并从催化剂表面逸出
"]]由图可知,在$\rm Fe$基催化剂表面,$\text{N}{{\text{H}}_{\text{3}}}$吸附在酸性配位点上形成$\text{NH}_{\text{4}}^{+}$,$\text{NO}$与${{\text{O}}_{\text{2}}}$吸附在$\text{F}{{\text{e}}^{\text{3+}}}$配位点上形成$\text{N}{{\text{O}}_{\text{2}}}$,然后$\text{NH}_{\text{4}}^{+}$与$\text{N}{{\text{O}}_{\text{2}}}$结合生成$\text{N}{{\text{O}}_{\text{2}}}{{\left( \text{NH}_{\text{4}}^{+} \right)}_{\text{2}}}$,最后$\text{N}{{\text{O}}_{\text{2}}}{{\left( \text{NH}_{\text{4}}^{+} \right)}_{\text{2}}}$与$\text{NO}$反应生成$\text{N}_{\text{2}},\text{H}_{\text{2}}\text{O}$,并从催化剂表面逸出,使得有氧条件下,在$\text{Fe}$基催化剂表面,$\text{N}{{\text{H}}_{\text{3}}}$还原$\text{NO}$生成氮气和水;
近年来,低温等离子技术是在高压放电下,$\rm O_{2}$产生$\text{O}*$自由基,$\text{O}*$自由基将$\rm NO$氧化为$\rm NO_{2}$后,再用$\rm Na_{2}CO_{3}$溶液吸收,达到消除$\rm NO$的目的。实验室将模拟气$\rm (N_{2}$、$\rm O_{2}$、$\rm NO)$以一定流速通入低温等离子体装置,实验装置如图$\rm 3$所示。
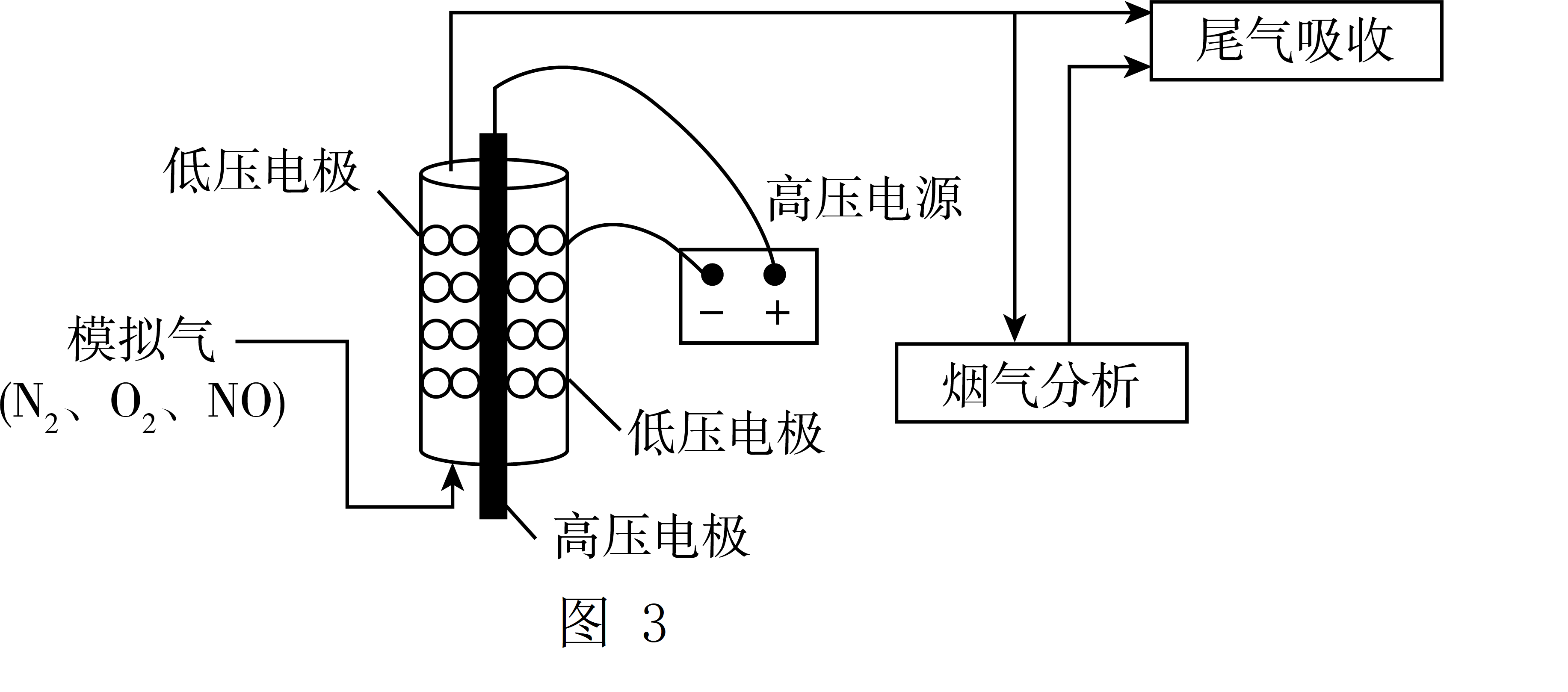
①等离子体技术在低温条件下可提高$\text{NO}$的转化率,原因是 。
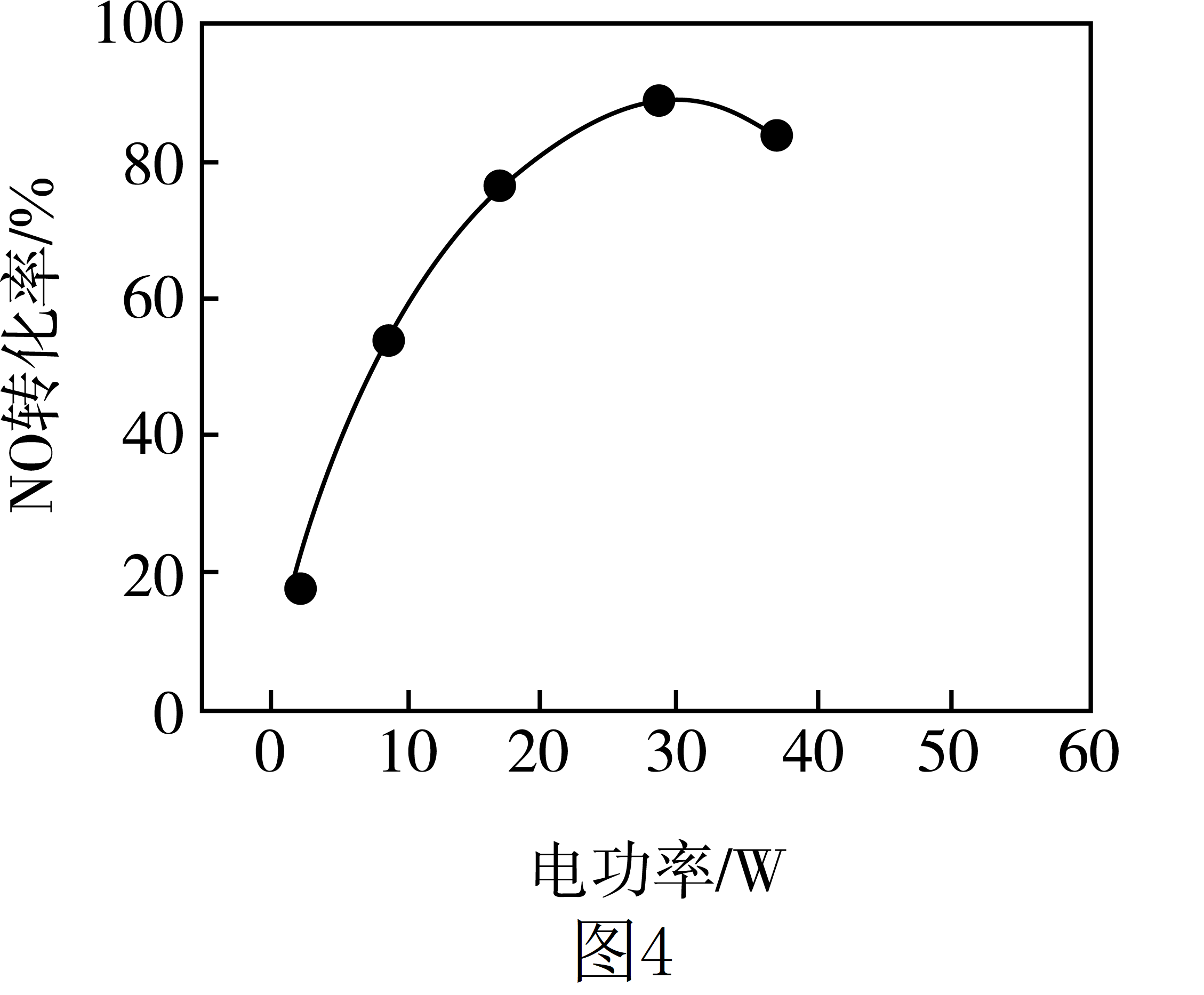
②其他条件相同,等离子体的电功率与$\text{NO}$的转化率关系如图$\rm 4$所示,当电功率大于$\text{30\;\rm W}$时,$\text{NO}$转化率下降的原因可能是 。
①$\\rm NO$与$\\rm O_{2}$反应生成$\\rm NO_{2}$是放热反应,低温时有利于反应的正向进行;
②功率增大时,会产生更多的$\\rm O$*自由基,$\\rm NO$更易被氧化为$\\rm NO_{2}$;功率增大,$\\rm N_{2}$和$\\rm O_{2}$在放电时会生成$\\rm NO$;相比而言,后者产生的$\\rm NO$更多
"]]①$\rm NO$与$\rm O_{2}$反应生成$\rm NO_{2}$是放热反应,低温时有利于反应的正向进行,从而使得$\rm NO$的转化率提高,而等离子体技术在低温条件下可以使得反应进行,故可提高$\text{NO}$的转化率;
②低温等离子技术是在高压放电下,$\rm O_{2}$产生$\text{O}*$自由基,$\text{O}*$自由基将$\rm NO$氧化为$\rm NO_{2}$;功率增大时,会产生更多的$\rm O$*自由基,$\rm NO$更易被氧化为$\rm NO_{2}$;而功率过大,$\rm N_{2}$和$\rm O_{2}$在放电时会生成$\rm NO$;相比而言,后者产生的$\rm NO$更多,使得当电功率大于$\text{30\;\rm W}$时,$\text{NO}$转化率下降。
高中 | 盖斯定律题目答案及解析(完整版)
