高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
电子元件废料中金$\rm (Au)$和$\rm Cu$以单质存在,以其为原料回收$\rm Au$、$\rm Cu$单质的方法如下图所示(其他杂质不参与反应)。
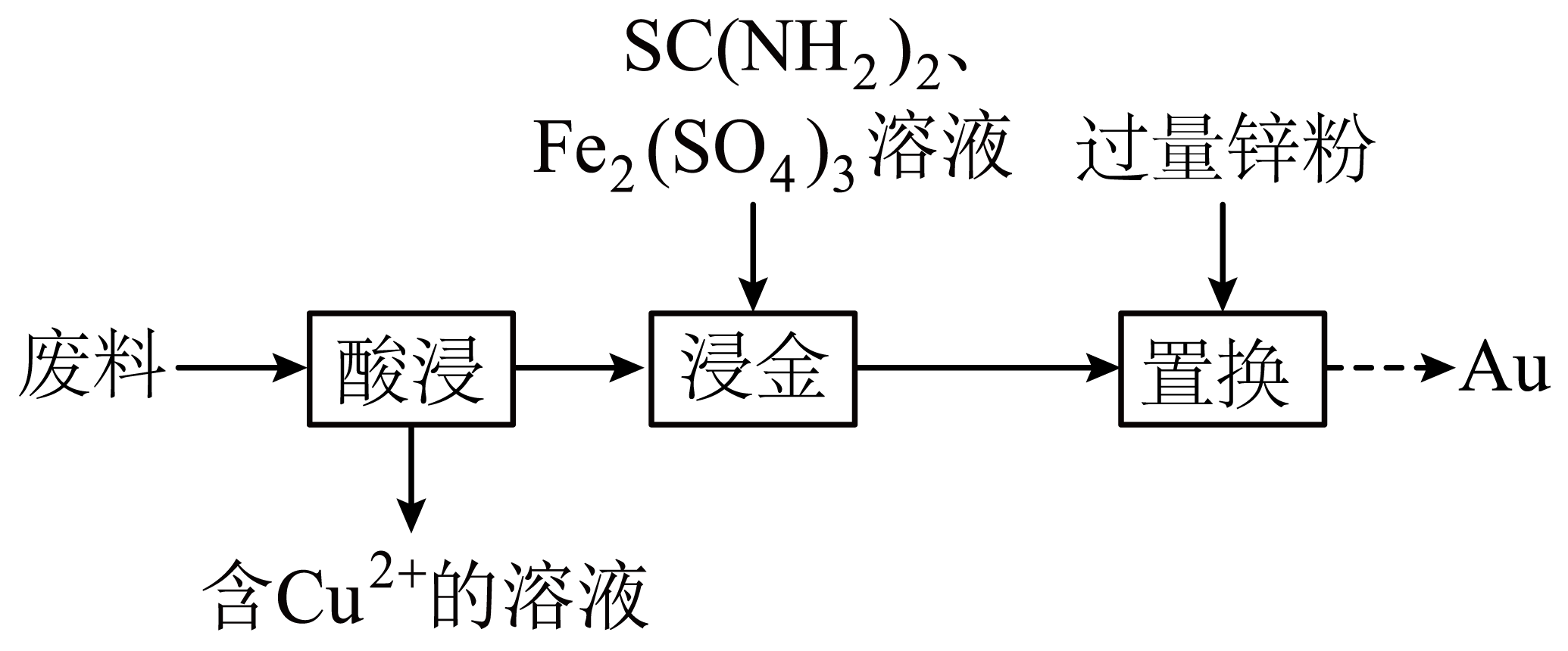
已知:硫脲$\left[ \text{SC}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}} \right]$可被缓慢氧化,最终生成单质硫。
①基态$\text{F}{{\text{e}}^{3+}}$的核外电子排布式为 。
②“浸金”时,溶液中生成${{\left[ \text{AuSC}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}} \right]}^{+}}$和$\text{F}{{\text{e}}^{2+}}$,该反应的离子方程式为 。
③硫脲中存在如图所示的转化,${{\left[ \text{AuSC}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}} \right]}^{+}}$中的配位原子为 。
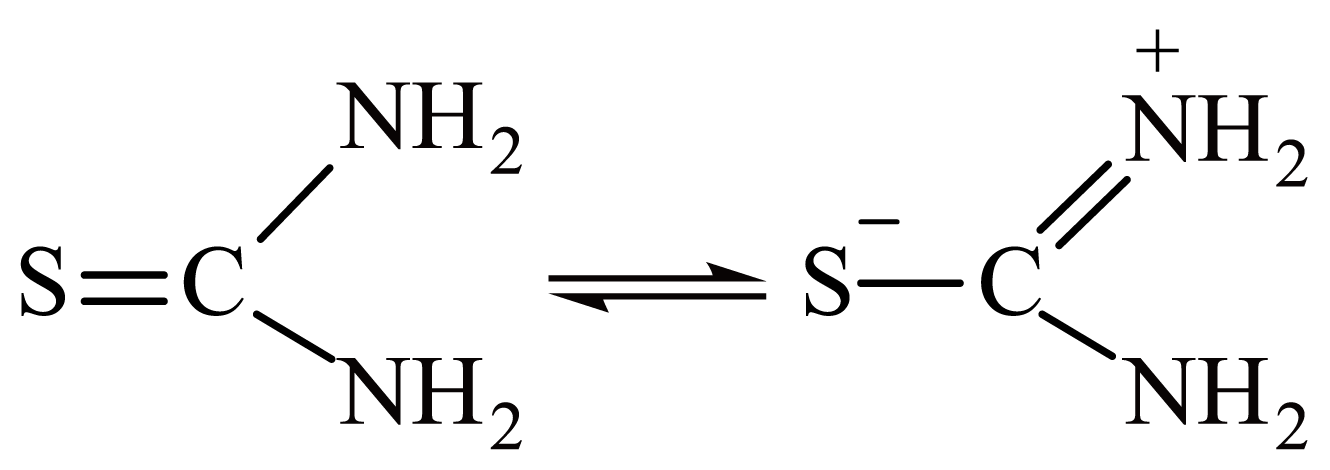
$1{{\\text{s}}^{2}}2{{\\text{s}}^{2}}2{{\\text{p}}^{6}}3{{\\text{s}}^{2}}3{{\\text{p}}^{6}}3{{\\text{d}}^{5}}$ ; $\\rm Au+Fe^{3+}+[SC(NH_{2})_{2}\\left] =\\right[AuSC(NH_{2})_{2}]^{+}+Fe^{2+}$ ;$\\rm S$、$\\rm N$
"]]①基态 $\rm Fe$ 的原子序数为 $\rm 26$,其核外电子排布式为:$1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{\text{p}}^{6}}3{{\text{s}}^{2}}3{{\text{p}}^{6}}3{{\text{d}}^{6}}4{{\text{s}}^{2}}$,因此,基态$\text{F}{{\text{e}}^{3+}}$的核外电子排布式为:$1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{\text{p}}^{6}}3{{\text{s}}^{2}}3{{\text{p}}^{6}}3{{\text{d}}^{5}}$;
②$\rm Au$ 被氧化为$\rm [AuSC(NH_{2})_{2}]^{+}$,$\rm Fe^{3+}$被还原为$\rm Fe^{2+}$,离子方程式为:$\rm Au+Fe^{3+}+[SC(NH_{2})_{2}\left] =\right[AuSC(NH_{2})_{2}]^{+}+Fe^{2+}$;
③根据硫脲的转化可知,带正电的$\rm N$原子没有孤对电子,不能形成配位键,则由$\rm S$原子和另外的$\rm N$原子提供孤对电子与$\rm Au^{+}$形成配位键;
硫脲浓度对金的浸出率的影响如图,其他条件相同时,硫脲浓度大于$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$时,金浸出率下降的原因是 。
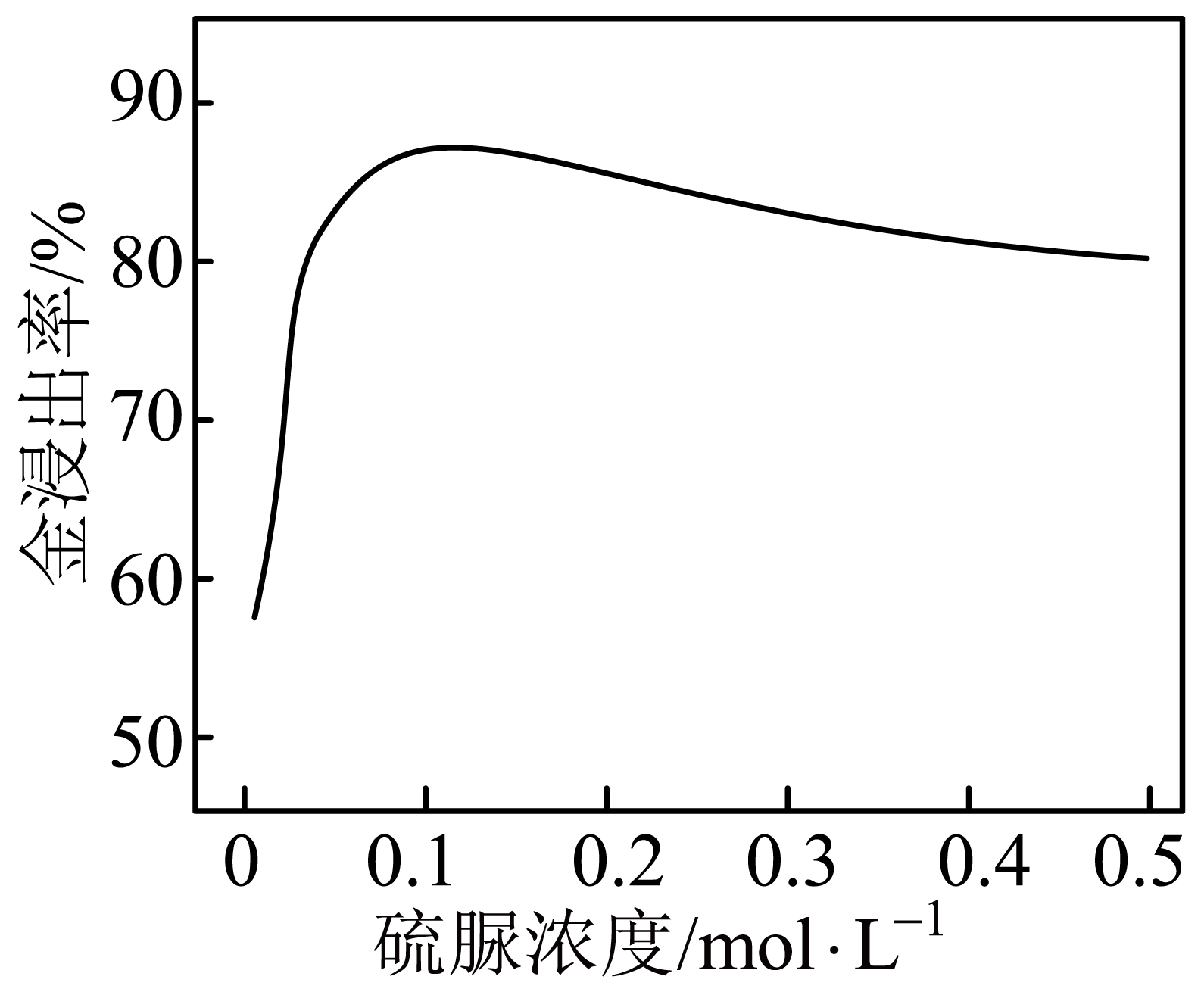
硫脲浓度过大,被缓慢氧化为$\\rm S$单质,包裹在金的表面
"]]硫脲浓度大于$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$时,被缓慢氧化为$\rm S$单质,包裹在金的表面,所以金浸出率下降;
“置换”后,过滤所得金粉中含有的金属杂质为 。
$\\rm Fe$
"]]“置换”时,金属锌会将“浸金”时,生成的$\text{F}{{\text{e}}^{\text{2}}}^{+}$还原为$\rm Fe$,则金粉中含有的金属杂质为$\rm Fe$;
请补充从电子元件废料中回收$\rm Cu$单质的实验方案,酸浸实验装置如图所示:取一定量的电子元件废料加入三颈烧瓶, ,关闭电源,收集阴极生成的铜。(必须使用:浓硝酸,$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\ \text{NaOH}$溶液,直流电源,铜电极,石墨电极)。
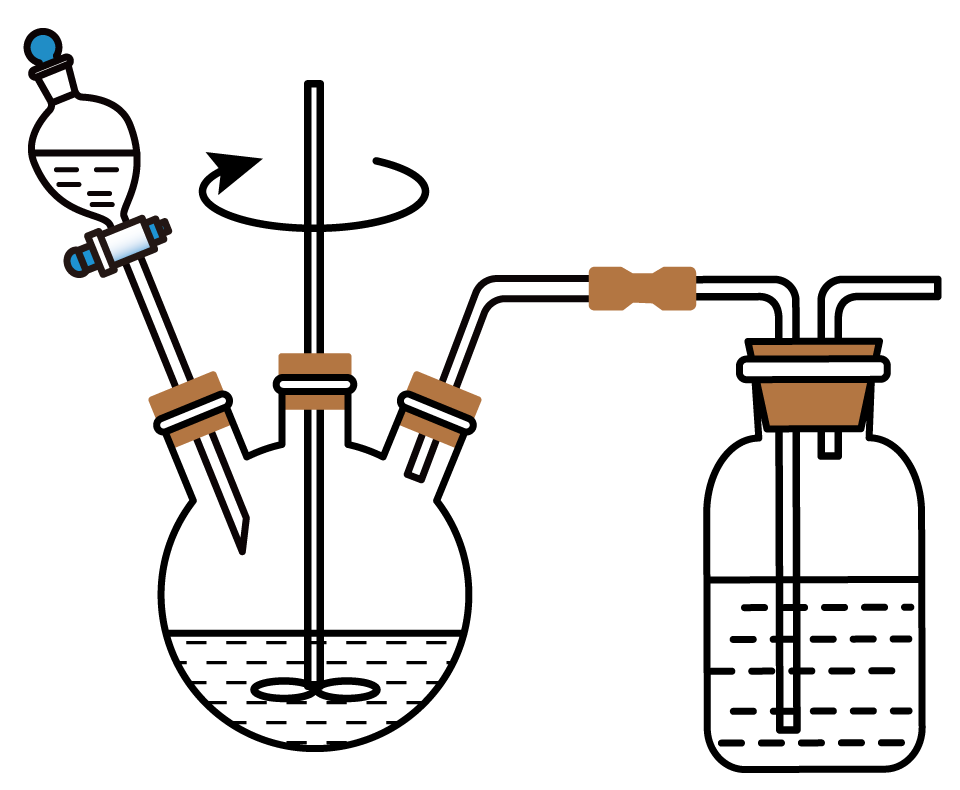
加入浓硝酸至$\\rm Cu$完全溶解,过滤,用 $\\rm 0.1$ $\\rm mol/L$ $\\rm NaOH$ 调节滤液 $\\rm pH$ 至中性,以石墨为阳极、铜为阴极,接通直流电源电解。
"]]有题意可知,需要电解法回收金属铜,硝酸用于溶解金属铜,$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\ \text{NaOH}$溶液用于调节$\rm pH$否则阴极存在副反应氢离子放电生成氢气,直流电源,铜电极,石墨电极用于电解法制取铜,故实验方案为:取一定量的电子元件废料加入三颈烧瓶,加入浓硝酸至$\rm Cu$完全溶解,过滤,用 $\rm 0.1$ $\rm mol/L$ $\rm NaOH$ 调节滤液 $\rm pH$ 至中性,以石墨为阳极、铜为阴极,接通直流电源电解。
高中 | 配合物理论题目答案及解析(完整版)
