高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
甲烷和水蒸气催化重整制氢过程中的主要反应为
①$\text{C}\text{H}_{4}(\text{g})+\text{H}_{2}\text{O}(\text{g})=\text{CO}(\text{g})+3\text{H}_{2}(\text{g})\qquad\Delta\textit{H}=+205.8\ \text{kJ/mol}$
②$\text{CO}(\text{g})+\text{H}_{2}\text{O}(\text{g})=\text{C}\text{O}_{2}(\text{g})+\text{H}_{2}(\text{g})\qquad\Delta\textit{H}=-41.2\ \text{kJ/mol}$
在装有催化剂的密闭容器中,$4.3\times {{10}^{6}}\;\rm \text{Pa}$、$\textit{n}(\text{C}\text{H}_{4}):\textit{n}(\text{H}_{2}\text{O})=1:6$时,若仅考虑上述反应,平衡时$\text{C}{{\text{H}}_{4}}$转化率和$\rm CO$转换率随温度的变化如图所示。
$\rm CO$转换率$=\dfrac{\textit{n}(\text{C}\text{O}_{2})}{\textit{n}(\text{CO})+\textit{n}(\text{C}\text{O}_{2})}\times100\%$
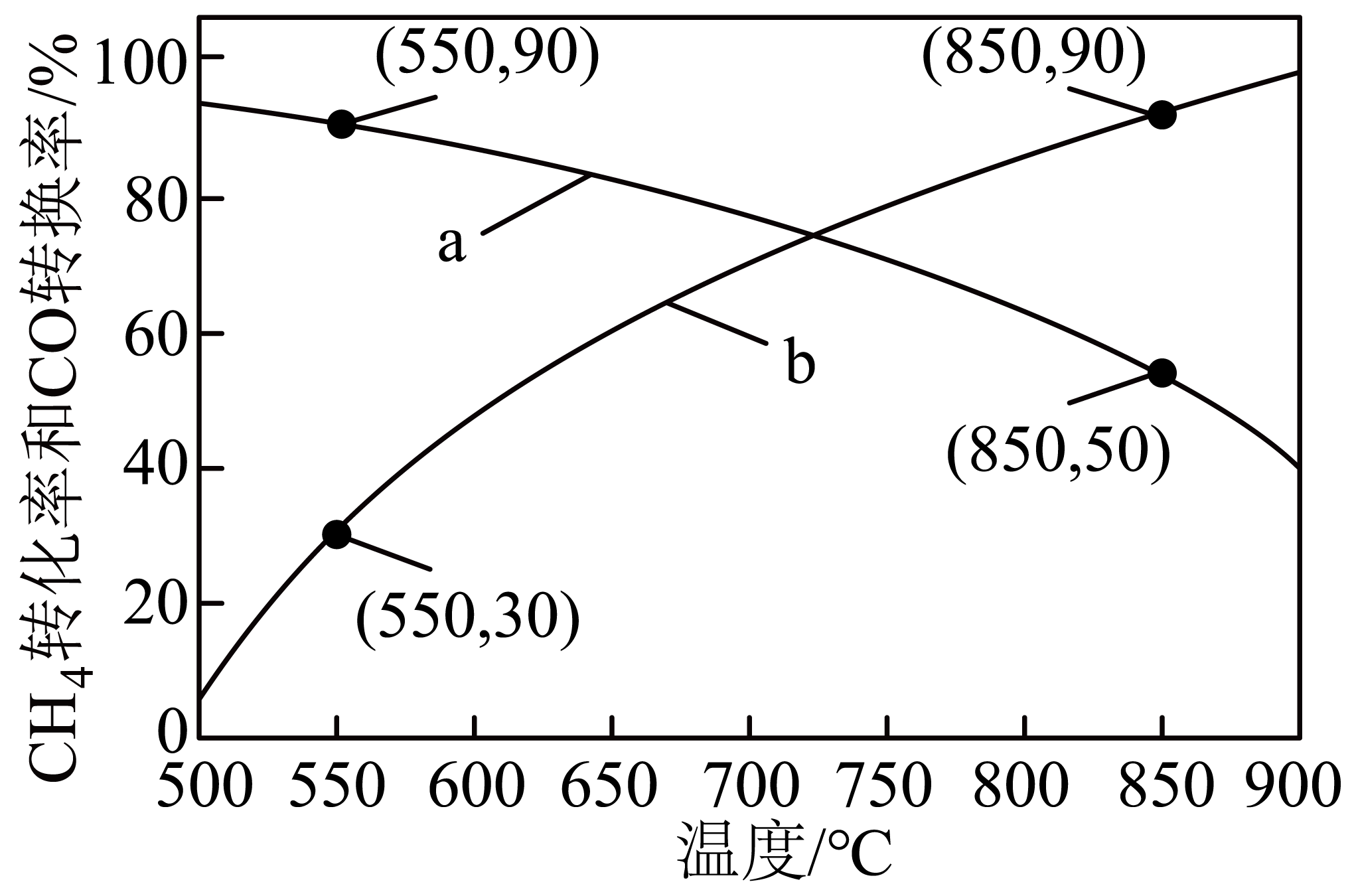
下列说法正确的是$(\qquad)$
反应$\\text{C}{{\\text{H}}_{4}}(\\text{g})+2{{\\text{H}}_{2}}\\text{O}(\\text{g})=\\text{C}{{\\text{O}}_{2}}(\\text{g})+4{{\\text{H}}_{2}}(\\text{g})$的焓变$\\Delta\\textit{H}=+247.0\\ \\text{kJ/mol}$
","曲线$\\rm a$表示平衡时$\\text{C}{{\\text{H}}_{4}}$转化率随温度的变化
","$\\rm 850\\;\\rm ^\\circ\\rm C$平衡时生成的$\\text{C}{{\\text{O}}_{2}}$比$\\rm 550\\;\\rm ^\\circ\\rm C$平衡时生成的多
","相同条件下,$\\text{C}{{\\text{H}}_{4}}$和${{\\text{H}}_{2}}\\text{O}$总物质的量不变,$\\dfrac{\\textit{n}(\\text{H}_{2}\\text{O})}{\\textit{n}(\\text{C}\\text{H}_{4})}$越大,${{\\text{H}}_{2}}$产量越高
"]$\rm A$.根据盖斯定律,①$\rm +$②得$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)$ $\qquad\Delta \textit{H}=\left( 205.8-41.2 \right)\ \rm kJ/mol=\rm +164.6\;\rm kJ/mol$,$\rm A$错误;
$\rm B$.$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)=\text{CO}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta\!\!\textit{ H}=+205.8\ \text{kJ/mol}$,该反应为吸热反应,升高温度,平衡正向移动,$\text{C}{{\text{H}}_{4}}$的平衡转化率增大,故曲线$\rm b$表示平衡时$\text{C}{{\text{H}}_{4}}$转化率随温度的变化,$\rm B$错误;
$\rm C$.设起始$\rm \textit{n}\left( C{{H}_{4}} \right)=1\;\rm mol$,$\rm 850\;\rm ^\circ\rm C$平衡时$\text{C}{{\text{H}}_{4}}$转化率为$\rm 90\%$,$\rm CO$转换率为$\rm 50\%$,$\textit{n}\left(\rm CO \right)+\textit{n}\left(\rm C{{O}_{2}} \right)={{\textit{n}}_{转化}}\left(\rm C{{H}_{4}} \right)=1\;\rm mol\times 90\%=0.9\;\rm mol$,$\textit{n}\left(\rm C{{O}_{2}} \right)=0.9\;\rm mol\times 50\%=0.45\;\rm mol$;$\rm 550\;\rm ^\circ\rm C$平衡时$\rm CH_{4}$的转化率为$\rm 30\%$,$\rm CO$的转换率为$\rm 90\%$,$\textit{n}\left(\rm CO \right)+\textit{n}\left(\rm C{{O}_{2}} \right)={{\textit{n}}_{转化}}\left(\rm C{{H}_{4}} \right)=1\;\rm mol\times 30\%=0.3\;\rm mol$,$\textit{n}\left(\rm C{{O}_{2}} \right)=0.3\;\rm mol\times 90\%=0.27\;\rm mol$,$\rm 850\;\rm ^\circ\rm C$平衡时生成的$\text{C}{{\text{O}}_{2}}$比$\rm 550\;\rm ^\circ\rm C$平衡时生成的多,$\rm C$正确;
$\rm D$.相同条件下,$\text{C}{{\text{H}}_{4}}$和${{\text{H}}_{2}}\text{O}$总物质的量不变,$\dfrac{\textit{n}(\text{H}_{2}\text{O})}{\textit{n}(\text{C}\text{H}_{4})}$越大,$\text{C}{{\text{H}}_{4}}$的量越小,$\rm CH_{4}$是反应物,当$\rm CH_{4}$的量很少时,${{\text{H}}_{2}}$的产量会降低,$\rm D$错误;
故选:$\rm C$
高中 | 盖斯定律题目答案及解析(完整版)
