高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
$\text{LiFeP}{{\text{O}}_{4}}$、${ \mathrm{Li}_{x} \mathrm{MoS}_{2} }$、$\text{LiCo}{{\text{O}}_{2}}$等均可作锂离子电池的电极材料。
$\text{LiFeP}{{\text{O}}_{4}}$电极。将${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}$、${{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}$与$\text{LiOH}$溶液发生共沉淀反应,所得沉淀经$80\;^{\circ}\text{C}$真空干燥、高温成型,制得电池的正极材料$\text{LiFeP}{{\text{O}}_{4}}$。
①投料时,先将${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}$与 直接混合,再向其中加入另一种溶液。
②共沉淀的化学方程式为 。
③高温成型前,常向$\text{LiFeP}{{\text{O}}_{4}}$中加入少量活性炭黑,其作用是 。
$\\text{H}_{3}\\text{P}\\text{O}_{4}$;$\\left( \\mathrm{NH}_{4}\\right)_{2}\\mathrm{Fe}\\left( \\mathrm{SO}_{4}\\right)_{2}+\\mathrm{H}_{3}\\mathrm{PO}_{4}+\\mathrm{LiOH}=\\mathrm{LiFePO}_{4}\\downarrow+2\\mathrm{NH}_{4}\\mathrm{HSO}_{4}+\\mathrm{H}_{2}\\mathrm{O}$或${\\left(\\mathrm{NH}_{4}\\right)_{2} \\mathrm{Fe}\\left(\\mathrm{SO}_{4}\\right)_{2}+\\mathrm{H}_{3} \\mathrm{PO}_{4}+\\mathrm{LiOH}=\\mathrm{LiFePO}_{4}+\\left(\\mathrm{NH}_{4}\\right)_{2} \\mathrm{SO}_{4}+\\mathrm{H}_{2} \\mathrm{SO}_{4}+\\mathrm{H}_{2} \\mathrm{O}}$; 增强电极导电性,与空气中${{\\text{O}}_{2}}$反应,防止$\\text{F}{{\\text{e}}^{2+}}$被氧化
"]]①投料时,${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}$和$\text{LiOH}$直接混合,易生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化而生成氢氧化铁,故先将${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}$与${{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}$直接混合,再向其中加入另一种溶液;
②共沉淀的化学方程式为${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}+{{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}+\text{LiOH}=\text{LiFeP}{{\text{O}}_{4}}\downarrow +2\text{N}{{\text{H}}_{4}}\text{HS}{{\text{O}}_{4}}+{{\text{H}}_{2}}\text{O}$或${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}+{{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}+\text{LiOH}=\text{LiFeP}{{\text{O}}_{4}}+{{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{S}{{\text{O}}_{4}}+{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}+{{\text{H}}_{2}}\text{O}$;
③高温成型前,常向$\text{LiFeP}{{\text{O}}_{4}}$中加入少量活性炭黑,其作用是:增强电极导电性;与空气中${{\text{O}}_{2}}$反应,防止$\text{F}{{\text{e}}^{2+}}$被氧化;
${ \mathrm{Li}_{x} \mathrm{MoS}_{2} }$电极。层状$\text{Mo}{{\text{S}}_{2}}$晶体与石墨晶体结构类似,将$\text{L}{{\text{i}}^{+}}$嵌入层状$\text{Mo}{{\text{S}}_{2}}$充电后得到的${ \mathrm{Li}_{x} \mathrm{MoS}_{2} }$可作电池负极。
①该负极放电时的电极反应式为 。
②结合原子结构分析,$\text{L}{{\text{i}}^{+}}$能嵌入$\text{Mo}{{\text{S}}_{2}}$层间可能的原因是 。
${\\mathrm{Li}_{x} \\mathrm{MoS}_{2}-x \\mathrm{e}^{-}=\\mathrm{MoS}_{2}+x \\mathrm{Li}^{+}}$;$\\text{L}{{\\text{i}}^{+}}$半径小于层间距
"]]①将$\text{L}{{\text{i}}^{+}}$嵌入层状$\text{Mo}{{\text{S}}_{2}}$充电后得到的${ \mathrm{Li}_{x} \mathrm{MoS}_{2} }$可作电池负极放电时的电极反应式为$\text{L}\text{i}_{{x}}\text{Mo}\text{S}_{\text{2}}{-x}\text{e}^{-}\text{=Mo}\text{S}_{\text{2}}+x\text{L}\text{i}^{+}$;②$\text{L}{{\text{i}}^{+}}$为$\rm Li$失去一个电子形成,电子排布为$\rm 1s^{2}$,原子半径小,$\text{L}{{\text{i}}^{+}}$半径小于层间距,能嵌入$\text{Mo}{{\text{S}}_{2}}$层间;
$\text{LiCo}{{\text{O}}_{2}}$电极。从废锂电池正极材料$\text{LiCo}{{\text{O}}_{2}}$回收$\text{Li}$、$\text{Co}$等金属路线如下:
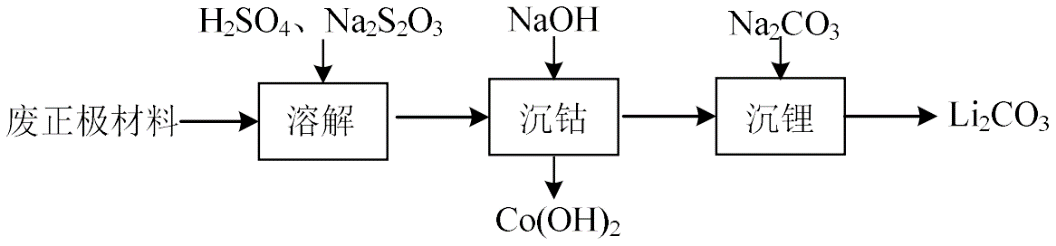
①写出“溶解”步骤发生反应的离子方程式: 。
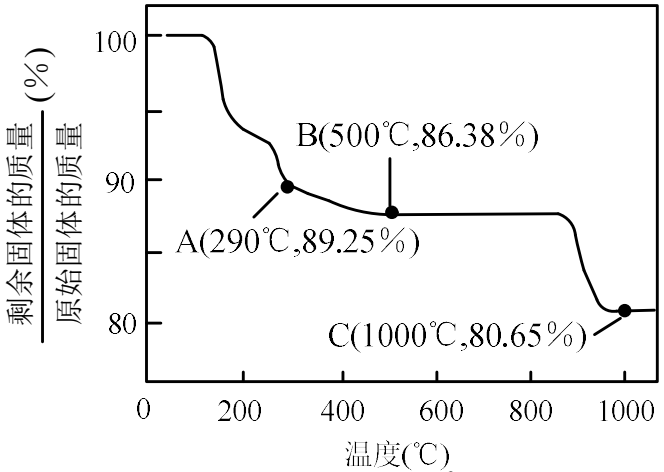
②$\text{Co}{{(\text{OH})}_{2}}$空气中加热时,固体残留率随温度的变化如图所示。已知${290\;{^\circ} \mathrm{C}}$以上,$\text{Co}{{(\text{OH})}_{2}}$已完全脱水,在$350\sim400\;^{\circ}\text{C}$范围内,剩余固体成分为 。$\rm ($写出计算过程$\rm )$。
③常温下${{K}_{\text{sp}}}\left( \text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}} \right)=2.2\times {{10}^{-3}}$,“沉锂”时使用饱和$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$的目的是 。
${8 \\mathrm{LiCoO}_{2}+\\mathrm{S}_{2} \\mathrm{O}_{3}^{2-}+22 \\mathrm{H}^{+}=8 \\mathrm{Li}^{+}+2 \\mathrm{SO}_{4}^{2-}+8 \\mathrm{Co}^{2+}+11 \\mathrm{H}_{2} \\mathrm{O}}$;$\\text{C}{{\\text{o}}_{3}}{{\\text{O}}_{4}}$和$\\text{C}{{\\text{o}}_{2}}{{\\text{O}}_{3}}$ ;提高$c\\left( \\text{CO}_{3}^{2-} \\right)$,促进$\\text{L}{{\\text{i}}_{2}}\\text{C}{{\\text{O}}_{3}}$充分沉淀
"]]①“溶解”步骤,正极材料与硫酸反应,$\rm Na_{2}S_{2}O_{3}$具有还原性,可将$\rm Co^{3+}$还原成$\rm Co^{2+}$,${{8 \mathrm{LiCoO}_{2}+\mathrm{S}_{2} \mathrm{O}_{3}^{2-}+22 \mathrm{H}^{+}=8 \mathrm{Li}^{+}+2 \mathrm{SO}_{4}^{2-}+8 \mathrm{Co}^{2+}+11 \mathrm{H}_{2} \mathrm{O}}\rm }$;
②根据质量守恒定律,在变化过程中,$\rm Co$的质量没有变,假设原始固体质量为$\rm 100\;\rm g$,则$ n\rm (Co)=\dfrac{100}{93}\;\rm mol$,$ m\rm (Co)=100\times \dfrac{59}{93}\;\rm g$;
在$\rm 1000\;\rm ^\circ\rm C$时,固体质量不再变化,说明$\rm Co(OH)_{2}$完全分解,$n\rm (Co)$:$n\rm (O)=\dfrac{100}{93}$:$\dfrac{\text{80}\text{.65-100 }\!\!\times\dfrac{\text{59}}{\text{93}}}{\text{16}}\rm =1$∶$\rm 1$,剩余固体成分为$\rm CoO$;
在$\rm 350-400\;\rm ^\circ\rm C$时,固体的质量在$\rm 89.25\%-86.38\%$之间,可以通过极点进行分析,
在$\rm 290\;\rm ^\circ\rm C$,$n\rm (Co)$:$n\rm (O)=\dfrac{100}{93}$:$\dfrac{\text{89}\text{.25-100 }\!\!\times\dfrac{\text{59}}{\text{93}}}{\text{16}}\rm =2$∶$\rm 3$,其化学式为$\rm Co_{2}O_{3}$;
在$\rm 500\;\rm ^\circ\rm C\;$,$n\rm (Co)$:$n\rm (O)=\dfrac{100}{93}$:$\dfrac{\text{86}\text{.38-100 }\!\!\times\dfrac{\text{59}}{\text{93}}}{\text{16}}\rm =3$∶$\rm 4$,其化学式为$\rm Co_{3}O_{4}$;
所以可以确定在$\rm 350-400\;\rm ^\circ\rm C$时的化学式为$\rm Co_{2}O_{3}$和$\rm Co_{3}O_{4}$,
③“沉锂”时$\text{2 L}\text{i}^{+}(\text{aq})\text{+CO}_{\text{3}}^{\text{2-}}(\text{aq})\rightleftharpoons\text{L}\text{i}_{\text{2}}\text{C}\text{O}_{\text{3}}(\text{s})$,提高$c\left( \text{CO}_{3}^{2-} \right)$,促进$\text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}}$充分沉淀。
高中 | 原电池工作原理题目答案及解析(完整版)
