高中 | 转化率、产率 题目答案及解析
稿件来源:高途
高中 | 转化率、产率题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
转化率、产率
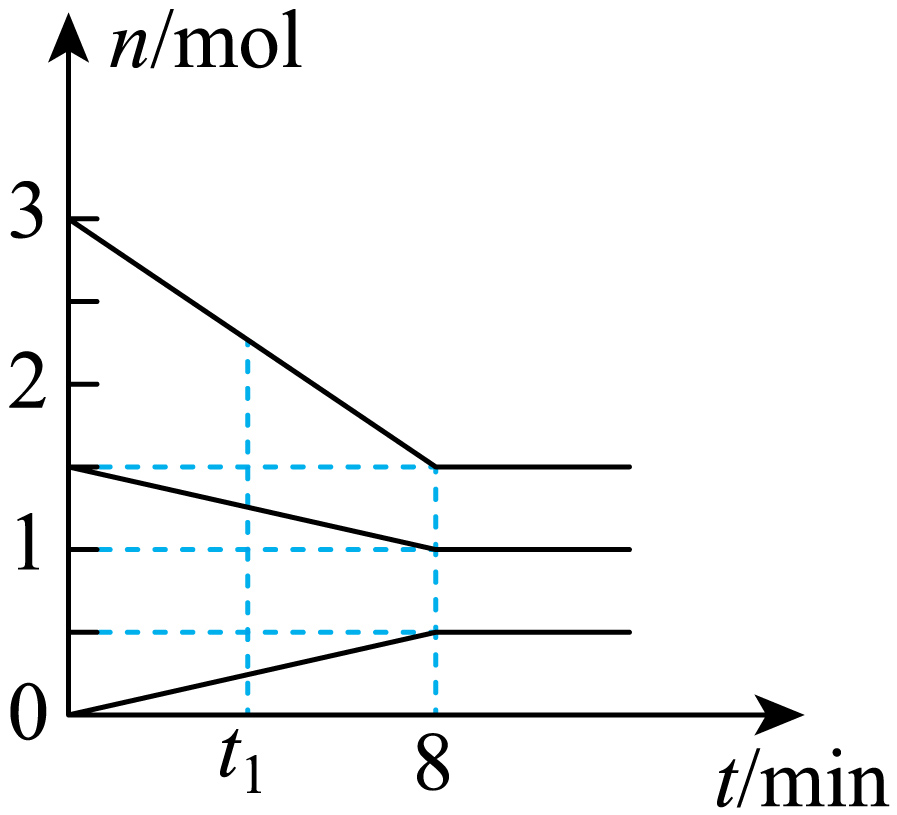
近年来,甲醇($\rm C{{H}_{3}}OH$)的制取与应用在全球引发了关于“甲醇经济”的广泛探讨,利用$\rm C{{O}_{2}}$加氢制甲醇已经成为研究热点。某温度下,在$\rm 5\;\rm L$的恒容密闭容器中通入$\rm 1.5\;\rm mol\;\rm C{{O}_{2}}\;、3\;\rm mol\;{{H}_{2}}$制取甲醇,$\rm C{{O}_{2}}\left( g \right)、{{H}_{2}}\left( g \right)、C{{H}_{3}}OH\left( g \right)、$和$\rm {{H}_{2}}O\left( g \right)$的物质的量随时间的变化如图所示,请回答下列问题:
写出该反应的化学方程式: ,已知该反应反应物的总键能小于生成物的总键能,则该反应为 (填“吸热”或“放热”)反应。
$\\rm C{{O}_{2}}\\left( g \\right)+3{{H}_{2}}\\left( g \\right)\\rightleftharpoons C{{H}_{3}}OH\\left( g \\right)+{{H}_{2}}O\\left( g \\right)$;放热
"]]由图可知,$\rm \Delta \textit n\left( C{{O}_{2}} \right)=0.5mol,\Delta\textit n\left( {{H}_{2}} \right)=1.5mol,\Delta \textit n\left( C{{H}_{3}}OH \right)=\Delta\textit n\left( {{H}_{2}}O \right)=0.5mol$,根据物质的量的变化量之比等于化学计量数之比,可知容器内发生反应的化学方程式为$\rm C{{O}_{2}}\left( g \right)+3{{H}_{2}}\left( g \right)\rightleftharpoons C{{H}_{3}}OH\left( g \right)+{{H}_{2}}O\left( g \right)$;$\rm \Delta H=$反应物的键能和-生成物的键能和<0,该反应为放热反应;
下列能说明该反应达到平衡状态的标志是 (填标号)。
$\rm a$.$\rm \textit v\left( C{{O}_{2}} \right):\textit v\left( {{H}_{2}} \right)=1:3$
$\rm b$.容器内气体压强不再改变
$\rm c$.容器内气体密度不再改变
$\rm d$.生成$\rm 0.1\;\rm mol\;\rm C{{H}_{3}}OH\left( g \right)$,同时消耗$\rm 0.1\;\rm mol\ {{H}_{2}}O\left( g \right)$
bd
"]]a.$\rm\textit v\left( C{{O}_{2}} \right):\textit v\left( {{H}_{2}} \right)=1:3$不能说明正、逆反应速率相等,反应不一定平衡,a错误;
b.容器为恒容容器,且该反应前后气体分子数不等,则压强是变量,则容器内气体压强不再改变可以证明反应达到平衡,b正确;
c.容器为恒容容器,且所有的反应物和产物都是气体,则气体总质量不变,密度不是变量,容器内气体密度不再改变不能证明反应达到平衡,c错误;
d.生成$\rm 0.1\ mol\ C{{H}_{3}}OH\left( g \right)$,同时消耗$\rm 0.1\ mol\ {{H}_{2}}O\left( g \right)$说明正、逆反应速率相等,则反应达到平衡,d正确;
故选bd;
$\rm {\textit{t}_{1}}min$时,$\rm {\textit{v}_{正}}$ (填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”)$\rm {\textit{v}_{逆}}$,此时$\rm C{{O}_{2}}$和$\rm {{H}_{2}}$的转化率 (填“相等”或“不相等”)。
$\\rm \\gt $ ;不相等
"]]由图可知,$\rm {\textit{t}_{1}}min$时反应物和产物的物质的量依然在改变,在正向进行,则$\rm \textit v$正$\rm \gt \textit v$逆,由于投料比例($\rm 1:2$)与化学计量数比例($\rm 1:3$)不同,$\rm H_{2}$的消耗量会更多,则氢气的转化率会大一些,故答案为不相等;
$\rm 0$∼$\rm 8\;\rm min$,用$\rm {{H}_{2}}$表示的平均反应速率为 $\rm \;\rm mol\cdot {{L}^{-1}}\cdot mi{{n}^{-1}}$,达到平衡时,甲醇的体积分数为 (保留三位有效数字)。
$\\rm 0.0375$或$\\rm 3.75\\times {{10}^{-2}}$ $\\rm; 14.3\\%$
"]]由图可知,0∼8min时$\rm \textit v\left( {{\text{H}}_{2}} \right)=\dfrac{3\ \text{mol}-1.5\ \text{mol}}{5\ \text{L}\times 8\ \text{min}}=0.0375\ \text{mol}\cdot {{\text{L}}^{-1}}\cdot mi{{n}^{-1}}$。根据图中数据可知,平衡时,$\rm\textit n\left( C{{O}_{2}} \right)=1\ mol$,$\rm \textit n\left( {{H}_{2}} \right)=1.5\ mol,\textit n\left( C{{H}_{3}}OH \right)=\textit n\left( {{H}_{2}}O \right)=0.5\ mol,{\textit{n}_{总}}=3.5\ mol$,甲醇的体积分数等于物质的量分数$\rm =\dfrac{0.5}{3.5}\times 100\%=14.3\%$;
请写出一种可以增大生成甲醇的反应速率的措施: 。
适当升高温度或加入高效催化剂(或其他合理答案)
"]]从反应速率的角度分析可以增大生成甲醇的反应速率的措施有:适当升高温度或加入高效催化剂(或其他合理答案)。
高中 | 转化率、产率题目答案及解析(完整版)
