高中 | 核素 题目答案及解析
稿件来源:高途
高中 | 核素题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第一节 元素周期表
核素
冶炼铜过程中产生的铜阳极泥富含$\rm Cu$、$\rm Se$、$\rm Te$等多种元素。研究人员设计了一种从铜阳极泥中分离提取硒和碲的流程,如图所示。
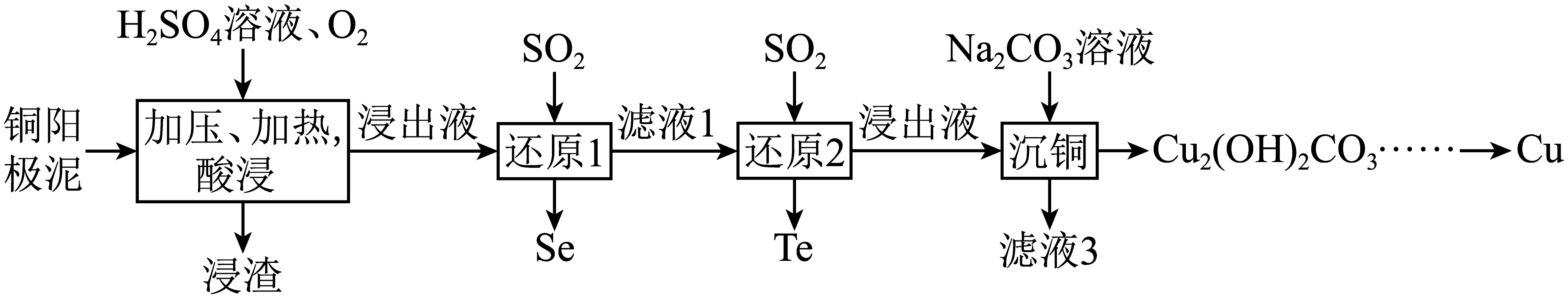
回答下列问题:
基态$\rm Se$原子核外电子排布式为 。硒有多种单质,比较有代表性的是灰硒和红硒,它们互为 。
$\\left[ \\text{Ar} \\right]3{{\\text{d}}^{10}}4{{\\text{s}}^{2}}4{{\\text{p}}^{4}}$或$1{{\\text{s}}^{2}}2{{\\text{s}}^{2}}2{{\\text{p}}^{6}}3{{\\text{s}}^{2}}3{{\\text{p}}^{6}}3{{\\text{d}}^{10}}4{{\\text{s}}^{2}}4{{\\text{p}}^{4}}$;同素异形体
"]]$\rm Se$ 是 $\rm 34$ 号元素,根据核外电子排布规律,其基态原子核外电子排布式为$1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{\text{p}}^{6}}3{{\text{s}}^{2}}3{{\text{p}}^{6}}3{{\text{d}}^{10}}4{{\text{s}}^{2}}4{{\text{p}}^{4}}$,也可用简化形式$\left[ \text{Ar} \right]3{{\text{d}}^{10}}4{{\text{s}}^{2}}4{{\text{p}}^{4}}$表示。灰硒和红硒是硒元素形成的不同单质,互为同素异形体。
“加压、加热,酸浸”步骤中,$\text{C}{{\text{u}}_{2}}\text{Se}$和$\text{C}{{\text{u}}_{2}}\text{Te}$分别转化为$\mathrm{H}_2 \mathrm{SeO}_4$和${{\text{H}}_{6}}\text{Te}{{\text{O}}_{6}}$,写出$\text{C}{{\text{u}}_{2}}\text{Se}$参与反应的化学方程式: 。
$2\\text{C}{{\\text{u}}_{2}}\\text{Se}+5{{\\text{O}}_{2}}+4{{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}\\begin{matrix} \\underline{\\underline{加热、加压}} \\\\ {} \\\\ \\end{matrix}4\\text{CuS}{{\\text{O}}_{4}}+2{{\\text{H}}_{2}}\\text{Se}{{\\text{O}}_{4}}+2{{\\text{H}}_{2}}\\text{O}$
"]]“加压、加热,酸浸”时,$\text{C}{{\text{u}}_{2}}\text{Se}$与${{\text{O}}_{2}}$、${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{4}}$反应,$\text{C}{{\text{u}}_{2}}\text{Se}$中$\rm Cu$为 $\rm +1$ 价,$\rm Se$为 $\rm -2$ 价 ,反应后$\rm Cu$转化为$\text{CuS}{{\text{O}}_{\text{4}}}$,$\rm Se$转化为${{\text{H}}_{\text{2}}}\text{Se}{{\text{O}}_{\text{4}}}$,${{\text{O}}_{2}}$作氧化剂,根据得失电子守恒和原子守恒配平化学方程式,$2\text{C}{{\text{u}}_{2}}\text{Se}+5{{\text{O}}_{2}}+4{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}\begin{matrix} \underline{\underline{加热、加压}} \\ {} \\ \end{matrix}4\text{CuS}{{\text{O}}_{4}}+2{{\text{H}}_{2}}\text{Se}{{\text{O}}_{4}}+2{{\text{H}}_{2}}\text{O}$。
试从化学反应原理的角度分析“加压”能提高$\rm Cu$、$\rm Se$、$\rm Te$浸出率的原因: 。
加压可增大氧气溶解度,加快化学反应速率;加压可提升溶液沸点,化学反应可在更高温度下发生,化学反应速率更快
"]]加压可增大氧气溶解度,溶液中${{\text{O}}_{2}}$浓度增大,加快化学反应速率,提高浸出率。同时加压可提升溶液的沸点,可使化学反应在更高的温度下发生,化学反应速率更快。
氧化性:$\mathrm{H}_2 \mathrm{SeO}_4$ $\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm ){{\text{H}}_{6}}\text{Te}{{\text{O}}_{6}}$。
$\\rm \\gt $
"]]同主族元素从上到下非金属性逐渐减弱,非金属性越强,其最高价含氧酸的氧化性越强。$\rm Se$ 和 $\rm Te$ 同主族,$\rm Se$ 在 $\rm Te$ 上方,非金属性 $\rm Se\gt Te$ ,所以氧化性${{\text{H}}_{\text{2}}}\text{Se}{{\text{O}}_{\text{4}}}\gt {{\text{H}}_{\text{6}}}\text{Te}{{\text{O}}_{\text{6}}}$。
“沉铜”中生成$\text{C}{{\text{u}}_{2}}{{\left( \text{OH} \right)}_{2}}\text{C}{{\text{O}}_{3}}$沉淀的离子方程式为 。
$2\\text{C}{{\\text{u}}^{2+}}+3\\text{CO}_{3}^{2-}+2{{\\text{H}}_{2}}\\text{O}=\\text{C}{{\\text{u}}_{2}}{{\\left( \\text{OH} \\right)}_{2}}\\text{C}{{\\text{O}}_{3}}\\downarrow +2\\text{HCO}_{3}^{-}\\rm [$或$2\\text{C}{{\\text{u}}^{2+}}+2\\text{CO}_{3}^{2-}+{{\\text{H}}_{2}}\\text{O}=\\text{C}{{\\text{u}}_{2}}{{\\left( \\text{OH} \\right)}_{2}}\\text{C}{{\\text{O}}_{3}}\\downarrow +\\text{C}{{\\text{O}}_{2}}\\uparrow \\rm ]$
"]]“沉铜”时,$\text{C}{{\text{u}}^{2+}}$与$\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{3}}$溶液反应生成$\text{C}{{\text{u}}_{\text{2}}}{{\left( \text{OH} \right)}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$沉淀,$\text{CO}_{3}^{2-}$水解产生$\text{O}{{\text{H}}^{-}}$,根据电荷守恒和原子守恒写出离子方程式$2\text{C}{{\text{u}}^{2+}}+3\text{CO}_{3}^{2-}+2{{\text{H}}_{2}}\text{O}=\text{C}{{\text{u}}_{2}}{{\left( \text{OH} \right)}_{2}}\text{C}{{\text{O}}_{3}}\downarrow +2\text{HCO}_{3}^{-}$。
由$\text{C}{{\text{u}}_{2}}{{\left( \text{OH} \right)}_{2}}\text{C}{{\text{O}}_{3}}$获取$\rm Cu$的过程中,常采用高压氢还原法直接从溶液中提取金属粉。还原时,增大溶液酸度不利于$\rm Cu$生成的原因是 。
在用${{\\text{H}}_{2}}$将$\\text{C}{{\\text{u}}^{2+}}$还原为$\\rm Cu$单质时,${{\\text{H}}_{2}}$失去电子被氧化为${{\\text{H}}^{+}}$,若还原时增大溶液的酸度,$c\\left(\\mathrm{H}^{+}\\right)$增大,不利于${{\\text{H}}_{2}}$失去电子
"]]高压氢还原时,${{\text{H}}_{2}}$作还原剂,${{\text{H}}_{2}}$失去电子被氧化为${{\text{H}}^{+}}$,增大溶液酸度,${{\text{H}}^{+}}$浓度升高,不利于${{\text{H}}_{2}}$失去电子,也就不利于$\rm Cu$的生成。
硫和碲位于元素周期表同一主族,试分析存在${{\text{H}}_{6}}\text{Te}{{\text{O}}_{6}}$而不存在${{\text{H}}_{6}}\text{S}{{\text{O}}_{6}}$的原因: 。
$\\rm S$原子半径小,其原子周围不能容纳$\\rm 6$个$-\\text{OH}$,而$\\rm Te$原子半径大,其原子周围能容纳的$-\\text{OH}$数目多
"]]原子半径影响原子周围可结合其他原子或原子团的数量,$\rm S$和$\rm Te$同主族,$\rm Te$原子半径大,有足够空间容纳多个$\rm -OH$ 形成${{\text{H}}_{\text{6}}}\text{Te}{{\text{O}}_{6}}$,$\rm S$原子半径小,空间限制使其难以形成含$\rm 6$个$\rm -OH$ 的${{\text{H}}_{\text{6}}}\text{S}{{\text{O}}_{\text{6}}}$。
高中 | 核素题目答案及解析(完整版)
