高中 | 电子空间运动状态(电子云) 题目答案及解析
稿件来源:高途
高中 | 电子空间运动状态(电子云)题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
电子空间运动状态(电子云)
镓、锗都是重要的半导体原材料,利用锌浸出渣$\rm ($主要成分有$\rm ZnO$、$\rm G{{a}_{2}}{{O}_{3}}$、$\rm {GeO}_2$,还有$\rm FeO$、$\rm F{{e}_{2}}{{O}_{3}}$、$\rm B{{i}_{2}}{{O}_{3}}$等杂质$\rm )$制备镓和锗的工艺流程如图:
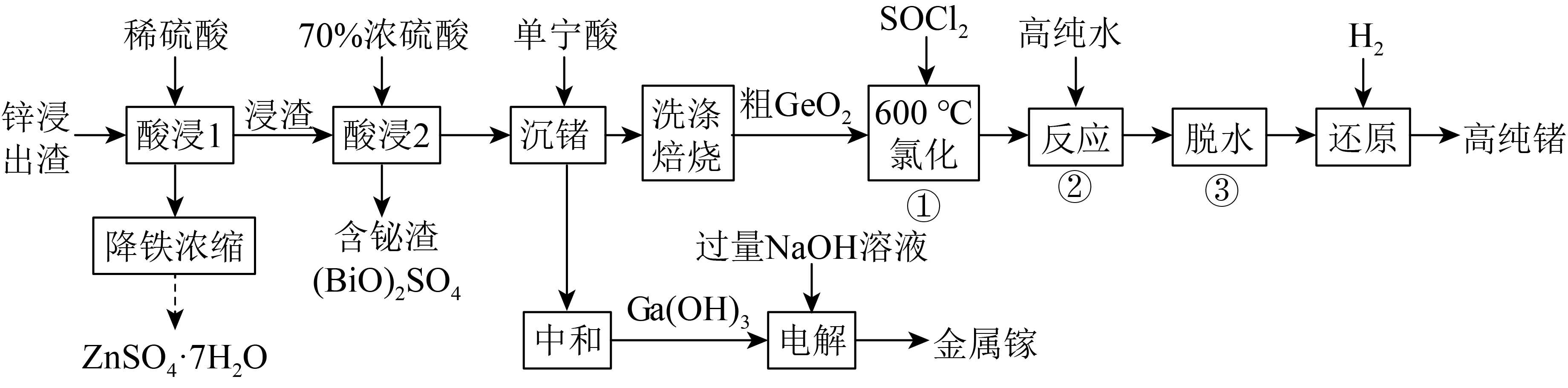
已知:Ⅰ.单宁酸是一种有机沉淀剂,可与四价锗络合形成沉淀。
Ⅱ.当金属离子浓度,$\rm 10^{-5} {\ mol} \cdot {L}^{-1}$时,认为该离子沉淀完全。常温下,浸出液中各离子开始形成氢氧化物沉淀和完全沉淀的$\rm pH$如表:
| 金属离子 | $\rm F{{e}^{3+}}$ | $\rm Z{{n}^{2+}}$ | $\rm G{{e}^{4+}}$ |
| 开始沉淀的$\rm pH$ | $\rm 1.7$ | $\rm 5.5$ | $\rm 8.2$ |
| 完全沉淀的$\rm pH$ | $\rm 3.2$ | $\rm 8.0$ | $\rm 11.2$ |
Ⅲ.镓元素与铝元素的性质相似,但高纯度的镓单质难溶于酸或碱。
回答下列问题:
基态氧原子最高能级的电子云轮廓图为 形,$\rm Zn$、$\rm Ga$、$\rm Ge$、$\rm Fe$、$\rm Bi$五种元素中属于$\rm p$区元素的是 $\rm ($填元素符号$\rm )$。
哑铃$\\rm ($或纺锤$\\rm )$;$\\rm Ga$、$\\rm Ge$、$\\rm Bi$
"]]基态氧原子的核外电子排布为$\rm 1s^{2}2s^{2}2p^{4}$,最高能级为$\rm 2p$轨道,其电子云轮廓图为哑铃$\rm ($或纺锤$\rm )$形;$\rm Ga$、$\rm Ge$、$\rm Bi$价电子排布分别为$\rm 4s^{2}4p^{1}$、$\rm 4s^{2}4p^{1}$、$\rm 4s^{2}4p^{2}$、$\rm 6s^{2}6p^{3}$,属于$\rm p$区元素;$\rm Fe$价电子排布为$\rm 3d^{6}4s^{2}$,属于$\rm d$区元素;$\rm Zn$价电子排布为$\rm 3d^{10}4s^{2}$,属于$\rm ds$区元素。
“降铁浓缩”过程分多步进行,其中加入$\rm {{H}_{2}}{{O}_{2}}$将铁元素转化为$\rm F{{e}^{3+}}$时发生反应的离子方程式为 ,为将$\rm F{{e}^{3+}}$完全沉淀,应控制$\rm pH$的范围为 。
$\\rm 2F{{e}^{2+}}+{{H}_{2}}{{O}_{2}}+2{{H}^{+}}=2F{{e}^{3+}}+2{{H}_{2}}O$;$\\rm {3.2 \\sim 5.5}($或$\\rm {3.2 \\leq {pH}\\lt 5.5})$
"]]“降铁浓缩”过程$\rm {{H}_{2}}{{O}_{2}}$将$\rm F{{e}^{2+}}$氧化为$\rm F{{e}^{3+}}$,反应的离子方程式为$\rm 2F{{e}^{2+}}+{{H}_{2}}{{O}_{2}}+2{{H}^{+}}=2F{{e}^{3+}}+2{{H}_{2}}O$;根据已知$\rm II$,$\rm F{{e}^{3+}}$完全沉淀、而$\rm Z{{n}^{2+}}$不沉淀的$\rm pH$的范围为$\rm {3.2 \sim 5.5}($或$\rm {3.2 \leq {pH}\lt 5.5})$。
从“降铁浓缩”后的滤液中获得$\rm ZnS{{O}_{4}}\cdot 7{{H}_{2}}O$的操作为 、过滤、洗涤、干燥。
蒸发浓缩、冷却结晶
"]]从“降铁浓缩”后的滤液中获得$\rm ZnS{{O}_{4}}\cdot 7{{H}_{2}}O$的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
已知:栲胶是以栲树中含单宁酸丰富的部分为原料经磨碎、水浸、过滤、脱色、真空浓缩等过程制得的物质。不同$\rm pH$条件下栲胶、单宁酸对镓的提取率的影响如图:
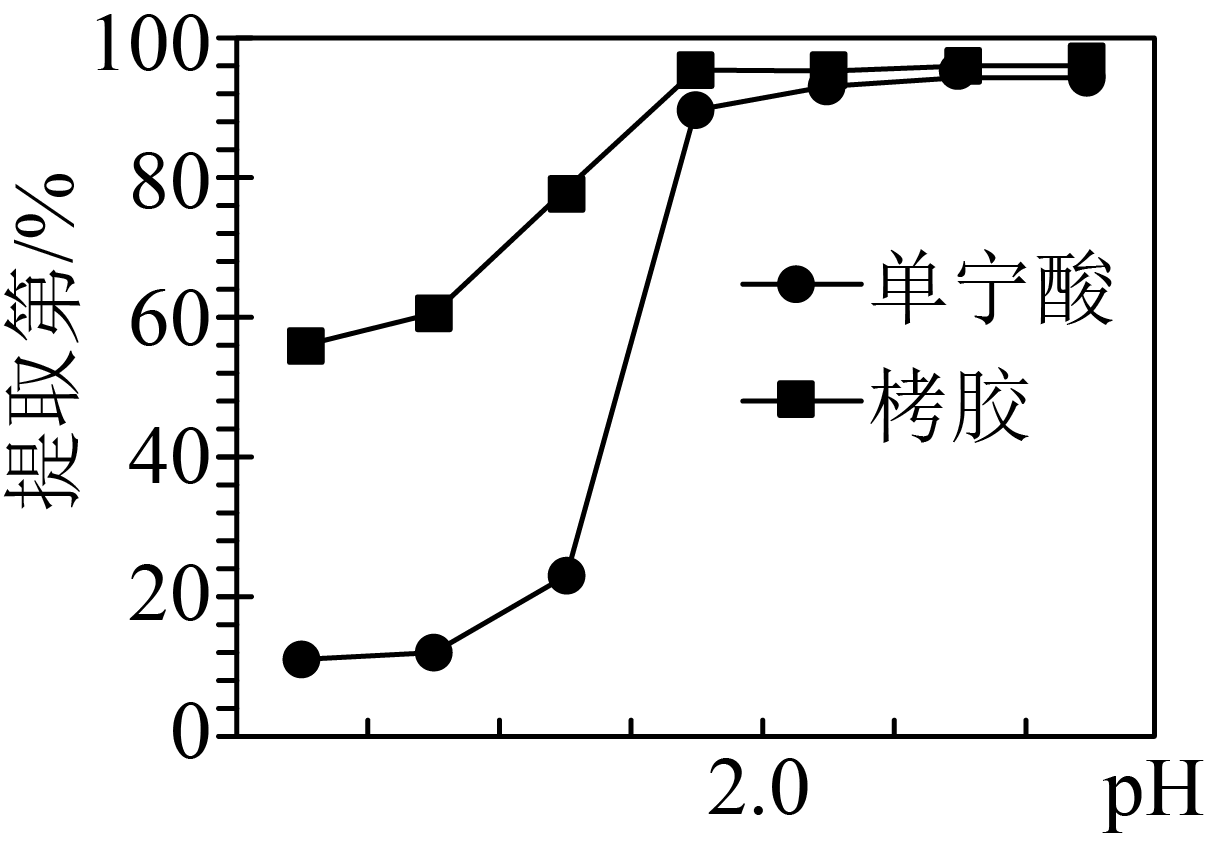
由图可知,相同$\rm pH$条件下,栲胶对镓的提取率高于单宁酸,试分析可能的原因: 。
栲胶中含有的杂质对单宁酸与镓形成的络合物具有一定的吸附作用$\\rm ($或其他合理答案$\\rm )$
"]]由图可知,相同$\rm pH$条件下,栲胶对镓的提取率高于单宁酸,可能的原因是:栲胶中含有的杂质对单宁酸与镓形成的络合物具有一定的吸附作用$\rm ($或其他合理答案$\rm )$。
已知:${{K}_{\rm sp}}\rm \left[ Ga{{(OH)}_{3}} \right]=1.0\times {{10}^{-34}}$。中和后,要使$\rm G{{a}^{3+}}$完全沉淀,需控制溶液的$\rm pH$略大于 $\rm ($保留两位有效数字$\rm )$;“电解”时阴极的电极反应式为 。
$\\rm 4.3$;$\\rm {{\\left[ Ga{{(OH)}_{4}} \\right]}^{-}}+3{{e}^{-}}=Ga+4O{{H}^{-}}$
"]]$\rm G{{a}^{3+}}$完全沉淀,则溶液中$\rm G{{a}^{3+}}$浓度为$\rm 1\times 10^{-5}\ mol/L$,$c{\rm (O{{H}^{-}})}\gt \sqrt[3]{\dfrac{1\times {{10}^{-34}}}{1\times {{10}^{-5}}}}={{10}^{-\frac{29}{3}}}={{10}^{-9.7}}$,${\rm pOH=-lg}c{\rm (O{{H}^{-}})}\lt 9.7$,$\rm pH=14-pOH\gt 14-9.67=4.3$;$\rm Ga(OH)_{3}$溶于过量$\rm NaOH$溶于得到$\rm {{\left[ Ga{{(OH)}_{4}} \right]}^{-}}$,因此“电解”时$\rm {{\left[ Ga{{(OH)}_{4}} \right]}^{-}}$在阴极得电子生成$\rm Ga$,电极反应式为$\rm {{\left[ Ga{{(OH)}_{4}} \right]}^{-}}+3{{e}^{-}}=Ga+4O{{H}^{-}}$。
已知:用$\rm SOC{{l}_{2}}$处理$\rm {GeO}_2$得到$\rm {GeCl}_4$,用高纯水水解$\rm {GeCl}_4$得到高纯的$\rm {GeO}_2$。“还原”过程中参与反应的$\rm {{H}_{2}}$体积为$\rm {134.4\ L}($标准状况下$\rm )$,则理论上步骤①中消耗$\rm SOC{{l}_{2}}$的物质的量为 $\rm \ mol$。
$\\rm 6$
"]]流程中$\rm GeO_{2}$经步骤①、②、③是为了除杂提纯,有关系式$\rm GeO_{2}\sim 2SOCl_{2}\sim GeCl_{4}\sim 2H_{2}$,可求得“还原”过程中参与反应的$\rm H_{2}$体积为$\rm 134.4\ L($标准状况下$\rm )$,则理论上步骤①中消耗$\rm SOCl_{2}$的物质的量为$\rm 6\ mol$。
高中 | 电子空间运动状态(电子云)题目答案及解析(完整版)
