高中 | 金属铝 题目答案及解析
稿件来源:高途
高中 | 金属铝题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第一节 金属的化学性质
金属铝
$\rm MnO_{2}$是重要的化工原料,由软锰矿制备$\rm MnO_{2}$的一种工艺流程如图:
![]()
资料:①软锰矿的主要成分为$\rm MnO_{2}$,主要杂质有$\rm Al_{2}O_{3}$和$\rm SiO_{2}$
②金属离子沉淀的$\rm pH$
| $\rm Fe^{3+}$ | $\rm Al^{3+}$ | $\rm Mn^{2+}$ | $\rm Fe^{2+}$ | |
| 开始沉淀时 | $\rm 1.5$ | $\rm 3.4$ | $\rm 5.8$ | $\rm 6.3$ |
| 完全沉淀时 | $\rm 2.8$ | $\rm 4.7$ | $\rm 7.8$ | $\rm 8.3$ |
③该工艺条件下,$\rm MnO_{2}$与$\rm H_{2}SO_{4}$不反应。
溶出:
①溶出前,软锰矿需研磨。目的是 。
②溶出时,$\rm Fe$的氧化过程及得到$\rm Mn^{2+}$的主要途径如图所示:
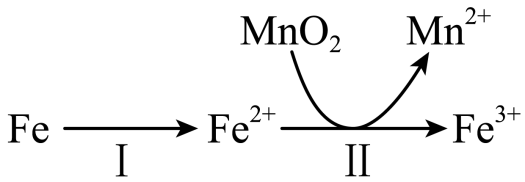
$\rm i$.步骤$\rm II$是从软锰矿中溶出$\rm Mn^{2+}$的主要反应,反应的离子方程式是 。
$\rm ii$.若$\rm Fe^{2+}$全部来自于反应$\rm Fe+2H^{+}=Fe^{2+}+H_{2}↑$,完全溶出$\rm Mn^{2+}$所需$\rm Fe$与$\rm MnO_{2}$的物质的量比值为$\rm 2$。而实际比值$\rm (0.9)$小于$\rm 2$,原因是 。
增大反应速率,提高浸出率;$\\rm MnO_{2}+4H^{+}+2Fe^{2+}\\begin{array}{*{20}{c}}{\\underline{\\underline {\\triangle}} }\\\\{}\\end{array} Mn^{2+}+2Fe^{3+}+2H_{2}O$;二氧化锰能够氧化单质铁为$\\rm Fe^{2+}$
"]]①研磨软锰矿可增大固体与硫酸的接触面积,增大反应速率,提高浸出率;②$\rm i.$根据反应途径可知,二氧化锰与亚铁离子反应生成二价锰离子和铁离子,则反应的离子方程式为$\rm MnO_{2}+4H^{+}+2Fe^{2+}\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array} Mn^{2+}+2Fe^{3+}+2H_{2}O$;$\rm ii.$根据方程式可知,$\rm Fe$与$\rm MnO_{2}$的物质的量比值为$\rm 2$,实际反应时,二氧化锰能够氧化单质铁为$\rm Fe^{2+}$,导致需要的$\rm Fe$减少,故实际比值$\rm (0.9)$小于$\rm 2$;
纯化:已知$\rm MnO_{2}$的氧化性随溶液$\rm pH$增大而减弱。纯化时先加入$\rm MnO_{2}$,后加入$\rm NH_{3}·H_{2}O$,调节溶液$\rm pH$为 ,说明试剂加入顺序的原因 。
$\\rm 4.7\\sim 5.8$;$\\rm MnO_{2}$的氧化性随酸性的减弱逐渐减弱
"]]$\rm MnO_{2}$的氧化性与溶液$\rm pH$有关,且随酸性的减弱,氧化性逐渐减弱,溶液显酸性时,二氧化锰的氧化性较强,故纯化时先加入$\rm MnO_{2}$,后加入$\rm NH_{3}·H_{2}O$,调节溶液$\rm pH$值为$\rm 4.7\sim 5.8$,除去溶液中的$\rm Al^{3+}$、$\rm Fe^{3+}$;
电解:$\rm Mn^{2+}$纯化液酸化后经电解得$\rm MnO_{2}$。用$\rm MnO_{2}$通过铝热反应制$\rm Mn$的化学方程式为 。
$\\rm 3MnO_{2}+4Al\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\rm 3Mn+2Al_{2}O_{3}$
"]]铝热反应是一种利用铝的还原性获得高熔点金属单质的方法,则$\rm MnO_{2}$通过铝热反应制$\rm Mn$的化学方程式为$\rm 3MnO_{2}+4Al\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\rm 3Mn+2Al_{2}O_{3}$;
产品纯度测定:向$ a\;\rm g$产品中依次加入足量$b\;\rm g\;Na_{2}C_{2}O_{4}$和足量稀$\rm H_{2}SO_{4}$,加热至充分反应。再用$c\;\rm mol·L^{-1}\; KMnO_{4}$溶液滴定剩余至终点,消耗$\rm KMnO_{4}$溶液的体积为$ d\;\rm L($已知:$\rm MnO_{2}$及$\rm MnO_{\text{4}}^{-}$均被还原为$\rm Mn^{2+}$。$\rm Na_{2}C_{2}O_{4}$的氧化产物为$\rm CO_{2}$。相对分子质量:$\rm MnO_{2}-86.94$;$\rm Na_{2}C_{2}O_{4}-134.0)$,求产品的纯度$\rm ($用质量分数表示,写出计算过程$\rm )$
部分草酸钠与二氧化锰发生氧化还原反应,剩余部分再与高锰酸钾反应$\\rm (5H_{2}C_{2}O_{4}+2KMnO_{4}+3H_{2}SO_{4}=K_{2}SO_{4}+2MnSO_{4}+10CO_{2}↑+8H_{2}O)$,则与二氧化锰反应的草酸钠为$\\dfrac{{b\\rm \\;g}}{134\\rm \\;{g}/{mol}} -\\dfrac{{c\\rm \\;mol}/{\\rm L}\\times {d\\rm \\;L}}{2}\\times 5$;$\\rm MnO_{2}+Na_{2}C_{2}O_{4}+2H_{2}SO_{4}=Na_{2}SO_{4}+MnSO_{4}+2CO_{2}↑+2H_{2}O$,则${ n\\rm (MnO_{2})}={n\\rm (Na_{2}C_{2}O_{4})}= \\dfrac{{b\\rm \\;g}}{134\\rm \\;{g}/{mol}} -\\dfrac{{c\\rm \\;mol}/{\\rm L}\\times {d\\rm \\;L}}{2}\\times 5$,产品纯度$ =\\dfrac{\\left( \\dfrac{{b\\rm \\;g}}{134\\rm \\;{g}/{mol}}-\\dfrac{{c\\rm \\;mol}/{\\rm L}\\times {d\\rm \\;L}}{2}\\times 5 \\right)\\times {86}{.94\\;\\rm g/mol}}{{a\\rm \\;g}} \\times 100\\%=\\dfrac{\\left( {b-335 cd} \\right)\\times {86}{.94}}{{134a}}$
"]]根据题意可知,部分草酸钠与二氧化锰发生氧化还原反应,剩余部分再与高锰酸钾反应$\rm (5H_{2}C_{2}O_{4}+2KMnO_{4}+3H_{2}SO_{4}=K_{2}SO_{4}+2MnSO_{4}+10CO_{2}↑+8H_{2}O)$,则与二氧化锰反应的草酸钠为$\dfrac{{b\rm \;g}}{134\rm \;{g}/{mol}} -\dfrac{{c\rm \;mol}/{\rm L}\times {d\rm \;L}}{2}\times 5$;$\rm MnO_{2}+Na_{2}C_{2}O_{4}+2H_{2}SO_{4}=Na_{2}SO_{4}+MnSO_{4}+2CO_{2}↑+2H_{2}O$,则${ n\rm (MnO_{2})}={n\rm (Na_{2}C_{2}O_{4})}= \dfrac{{b\rm \;g}}{134\rm \;{g}/{mol}} -\dfrac{{c\rm \;mol}/{\rm L}\times {d\rm \;L}}{2}\times 5$,产品纯度$ =\dfrac{\left( \dfrac{{b\rm \;g}}{134\rm \;{g}/{mol}}-\dfrac{{c\rm \;mol}/{\rm L}\times {d\rm \;L}}{2}\times 5 \right)\times {86}{.94\;\rm g/mol}}{{a\rm \;g}} \times 100\%=\dfrac{\left( {b-335 cd} \right)\times {86}{.94}}{{134a}}$。
高中 | 金属铝题目答案及解析(完整版)
