高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
为了节约资源,减少重金属对环境的污染,一研究小组对某有色金属冶炼厂的高氯烟道灰$\rm ($主要含有$\rm \text{CuC}{{\text{l}}_{\text{2}}}、\text{ZnC}{{\text{l}}_{\text{2}}}、\text{CuO}、\text{ZnO}、\text{PbO}、\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}、\text{Si}{{\text{O}}_{2}}$等$\rm )$进行研究,设计如下工艺流程。实现了铜和锌的分离回收。
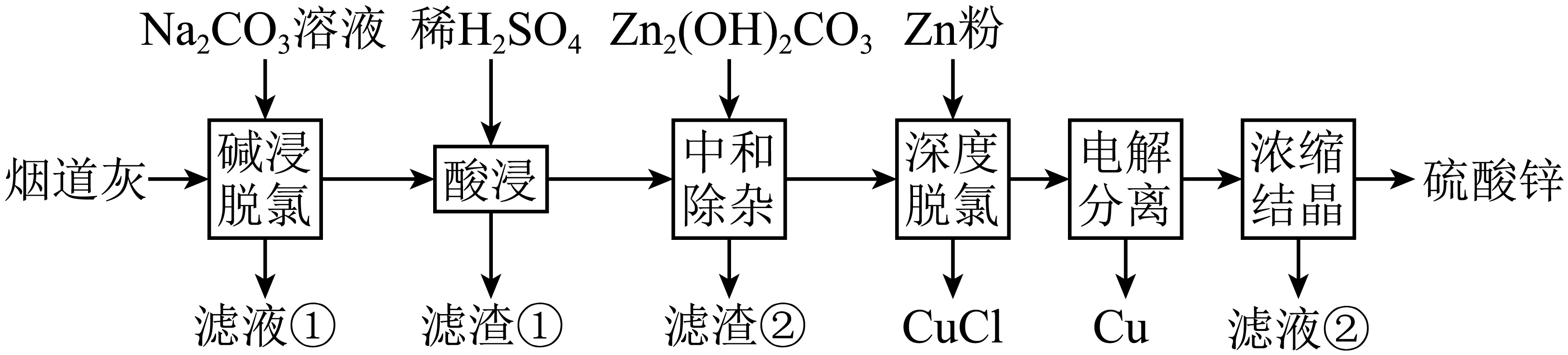
回答下列问题:
铜元素位于元素周期表第 周期、第 族。
四 ;Ⅰ$\\rm B$
"]]铜是$\rm 29$号元素,其核外电子排布为$\rm [Ar]3d^{10}4s^{1}$,根据元素周期表的结构,电子层数等于周期数,铜有$\rm 4$个电子层,所以位于第四周期;其价电子构型为$\rm 3d^{10}4s^{1}$,属于第Ⅰ$\rm B$族。
“碱浸脱氯”使可溶性铜盐、锌盐转化为碱式碳酸盐沉淀。其中,铜盐发生反应的化学方程式为 。
$\\rm 2CuCl_{2}+3Na_{2}CO_{3}+2H_{2}O=Cu_{2}(OH)_{2}CO_{3}↓+4NaCl+2NaHCO_{3}$或$\\rm 2CuCl_{2}+2Na_{2}CO_{3}+H_{2}O=Cu_{2}(OH)_{2}CO_{3}↓+4NaCl+CO_{2}\\uparrow $
"]]“碱浸脱氯”时,碳酸钠与氯化铜反应生成碱式碳酸铜$\rm [Cu_{2}(OH)_{2}CO_{3}]$、氯化钠和碳酸氢钠,化学方程式为$\rm 2CuCl_{2}+3Na_{2}CO_{3}+2H_{2}O=Cu_{2}(OH)_{2}CO_{3}↓+4NaCl+2NaHCO_{3}$或$\rm 2CuCl_{2}+2Na_{2}CO_{3}+H_{2}O=Cu_{2}(OH)_{2}CO_{3}↓+4NaCl+CO_{2}\uparrow $。
滤渣①中,除$\rm \text{Si}{{\text{O}}_{2}}$外,主要还有 。
$\\rm PbSO_{4}$
"]]烟道灰中的$\rm PbO$与稀$\rm H_{2}SO_{4}$反应生成$\rm PbSO_{4}$沉淀,$\rm SiO_{2}$不与稀$\rm H_{2}SO_{4}$反应,所以滤渣①中除$\rm SiO_{2}$外,还有$\rm PbSO_{4}$。
“中和除杂”步骤,调控溶液$\rm \text{pH=3}\text{.5}$左右,发生反应的离子方程式为 。
$\\rm \\text{4F}{{\\text{e}}^{3+}}+3\\text{Z}{{\\text{n}}_{2}}{{\\left( \\text{OH} \\right)}_{2}}\\text{C}{{\\text{O}}_{3}}+3{{\\text{H}}_{2}}\\text{O=4Fe(OH}{{\\text{)}}_{3}}+6\\text{Z}{{\\text{n}}^{2+}}+3\\text{C}{{\\text{O}}_{2}}\\uparrow $
"]]“中和除杂”步骤,调控溶液$\rm pH$ $\rm =$ $\rm 3.5$左右,此时溶液中的$\rm Fe^{3+}$会水解生成氢氧化铁沉淀,离子方程式为$\rm \text{F}{{\text{e}}^{3+}}+3{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{Fe(OH}{{\text{)}}_{3}}+3{{\text{H}}^{+}}$,加入的$\rm Zn_{2}(OH)_{2}CO_{3}$与$\rm H^{+}$反应,促进$\rm Fe^{3+}$的水解平衡正向移动,$\rm \text{Z}{{\text{n}}_{2}}{{(\text{OH})}_{2}}\text{C}{{\text{O}}_{3}}+4{{\text{H}}^{+}}=2\text{Z}{{\text{n}}^{2+}}+3{{\text{H}}_{2}}\text{O+C}{{\text{O}}_{2}}\uparrow $,总离子方程式为$\rm \text{3Z}{{\text{n}}_{2}}{{\left( \text{OH} \right)}_{2}}\text{C}{{\text{O}}_{3}}+3{{\text{H}}_{2}}\text{O+4F}{{\text{e}}^{\text{3+}}}=6\text{Z}{{\text{n}}^{2+}}+3\text{C}{{\text{O}}_{2}}\uparrow +4Fe{{\left( OH \right)}_{3}}$;
“深度脱氯”时,$\rm \text{C}{{\text{l}}^{-}}$的存在使锌粉还原产生的$\rm \text{Cu}$与$\rm \text{C}{{\text{u}}^{\text{2+}}}$反应,生成能被空气氧化的$\rm \text{CuCl}$沉淀,使$\rm \text{C}{{\text{l}}^{-}}$被脱除。欲脱除$\rm \text{1.0\;\rm mol\;\rm C}{{\text{l}}^{-}}$,理论上需要锌粉 $\rm \;\rm \text{mol}$。
$\\rm 0.5$
"]]“深度脱氯”时发生的反应为$\rm \text{Cu}+\text{C}{{\text{u}}^{2+}}+2\text{C}{{\text{l}}^{-}}=2\text{CuCl}$,从反应可知脱除$\rm 2\;\rm mol$ $\rm Cl^{-}$需要$\rm 1\;\rm mol$ $\rm Cu$,而$\rm Zn$与$\rm Cu^{2+}$反应生成$\rm Cu$的反应为$\rm \mathrm{Zn}+\mathrm{Cu}^{2+}=\mathrm{Zn}^{2+}+\mathrm{Cu}$,即生成$\rm 1\;\rm mol$ $\rm Cu$需要$\rm 1\;\rm mol$ $\rm Zn$。所以脱除$\rm 1.0\;\rm mol$ $\rm Cl^{-}$,根据反应比例关系,理论上需要锌粉$\rm 0.5\;\rm mol$。
$\rm \text{CuCl}$可以通过 $\rm ($填标号$\rm )$将其溶解,并返回到 步骤中。
$\rm a$.盐酸酸化、双氧水氧化 $\rm b$.硫酸酸化、$\rm \text{KMn}{{\text{O}}_{4}}$氧化
$\rm c$.硝酸酸化和氧化 $\rm d$.硫酸酸化、双氧水氧化
$\\rm d$; 碱浸脱氯
"]]$\rm a$.盐酸酸化和双氧水氧化使$\rm CuCl$转化为$\rm CuCl_{2}$,而最终要获得的是硫酸锌,氯离子为杂质,不能用盐酸,$\rm a$错误;
$\rm b$.$\rm KMnO_{4}$氧化会引入$\rm Mn^{2+}$、$\rm K^{+}$等杂质离子,$\rm b$错误;
$\rm c$.硝酸酸化和氧化会引入$\rm NO_{3}^{-}$,$\rm c$错误;
$\rm d$.$\rm \text{CuCl}$能被硫酸酸化的双氧水氧化,且没有引入杂质, $\rm d$正确;
故选:$\rm d$
硫酸酸化、双氧水氧化后的溶液可以返回到碱浸脱氯步骤。
“电解分离”采用无隔膜电解槽,以石墨为阳极,铜为阴极。
①“电解分离”时,阴极产生大量气泡,说明铜、锌分离已完成,其理由是 。
②“电解分离”前,需要脱氯的原因有 。
放电顺序:$\\rm C{{u}^{2+}}\\gt {{\\text{H}}^{+}}\\gt Z{{n}^{2+}}$,阴极产生大量气泡,说明溶液中已经没有$\\rm Cu^{2+}$,$\\rm Zn^{2+}$因氧化性弱于氢离子未参与反应,留在溶液中,实现铜、锌的分离 若不脱氯,$\\rm Cl^{-}$在阳极被氧化生成$\\rm Cl_{2}$污染环境,氯气可与阴极产生的氢气反应可能会发生爆炸,存在安全隐患,且影响铜、锌分离效果
"]]①“电解分离”时,放电顺序:$\rm C{{u}^{2+}}\gt {{\text{H}}^{+}}\gt Z{{n}^{2+}}$,阴极发生还原反应,阴极产生大量气泡,说明溶液中已经没有$\rm Cu^{2+}$(因为$\rm Cu^{2+}$会先在阴极得到电子被还原),$\rm Zn^{2+}$因氧化性弱于氢离子未参与反应,留在溶液中,此时溶液中的$\rm H^{+}$得到电子生成$\rm H_{2}$,产生气泡,所以说明铜、锌分离已完成。
②“电解分离”前,需要脱氯是因为$\rm Cl^{-}$在阳极会被氧化生成$\rm Cl_{2}$,污染环境,采用无隔膜电解槽,氯气可与阴极产生的氢气反应可能会发生爆炸,存在安全隐患,同时$\rm Cl^{-}$存在会使锌粉还原产生的$\rm Cu$与$\rm Cu^{2+}$反应生成$\rm CuCl$沉淀,影响铜的纯度。
高中 | 离子方程式题目答案及解析(完整版)
