高中 | 离子化合物 题目答案及解析
稿件来源:高途
高中 | 离子化合物题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第三节 化学键
离子化合物
含硒$\rm (Se)$化合物在材料药物领域有重要应用。
$\rm Se$与$\rm S$同族,基态$\rm Se$原子的简化电子排布式为 ,$\rm {{\operatorname{H}}_{2}}Se$的沸点高于$\rm {{\text{H}}_{2}}\text{S}$,原因是 。
$\\rm [Ar]3d^{10}4s^{2}4p^{4}$; 结构相似,分子的相对分子质量越大,分子间作用就越大,沸点越高,
"]]$\rm Se$为第四周期元素,氧族元素,因此基态硒原子简化电子排布式$\rm [Ar]3d^{10}4s^{2}4p^{4}$;
原因是$\rm H_{2}Se$与$\rm H_{2}S$结构相似,对于不含氢键的分子晶体来说,分子的相对分子质量越大,分子间作用就越大,沸点越高,$\rm {{\operatorname{H}}_{2}}Se$的沸点高于$\rm {{\text{H}}_{2}}\text{S}$
一种含硒的新型$\text{AIE}\rm ($聚集诱导发光$\rm )$分子Ⅳ的合成路线如下,下列关于路线中$\rm I\sim $Ⅳ的说法正确的有$(\quad\ \ \ \ )$。
Ⅰ中含有两种元素,$\\text{Se}-\\text{Se}$键为非极性键
","Ⅱ中$\\rm C$原子的杂化轨道类型有$\\mathrm{sp}^2$与$\\text{sp}$
","Ⅲ中含有的元素中,$\\rm O$的电负性最大
","Ⅳ中$\\text{Se}$原子的杂化轨道类型为$\\text{s}{{\\text{p}}^{3}}$
"]$\rm A$.Ⅰ中含有$\rm C$、$\rm H$、$\rm Se$三种元素,$\text{Se}-\text{Se}$键为非极性键,$\rm A$错误;
$\rm B$.Ⅱ中苯环上的碳原子与$\rm C=C$中的碳原子的杂化轨道类型为$\mathrm{sp}^2$,$\rm C≡C$中的碳为$\text{sp}$杂化,$\rm B$正确;
$\rm C$.Ⅲ含有$\rm H$、$\rm C$、$\rm N$、$\rm O$、$\rm S$元素,根据元素周期表中电负性变化规律可知$\rm O$的电负性最大,$\rm C$正确;
$\rm D$.Ⅳ中$\text{Se}$价层电子对:$\rm 2+\dfrac{6-2\times 1}{2}$ $\rm =4$ $\rm Se$原子的杂化轨道类型为$\text{s}{{\text{p}}^{3}}$,$\rm D$正确;
故选:$\rm BCD$。
硒的两种含氧酸的酸性强弱为$\mathrm{H}_2 \mathrm{SeO}_4$ ${{\text{H}}_{2}}\text{Se}{{\text{O}}_{3}}\rm ($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。研究发现,给小鼠喂食适量硒酸钠$\left( \text{N}{{\text{a}}_{2}}\text{Se}{{\text{O}}_{4}} \right)$可减轻重金属铊$\rm (\text{Tl}\rm )$引起的中毒,$\text{SeO}_{4}^{2-}$的空间结构为 。
$\\rm \\gt $; 正四面体;
"]]非羟基氧越多,酸性越强,因此酸性$\rm \mathrm{H}_2 \mathrm{SeO}_4$$\gt $${{\text{H}}_{2}}\text{Se}{{\text{O}}_{3}}$; $\text{SeO}_{4}^{2-}$中$\rm Se$价层电子对数为$\rm 4+\dfrac{6+2-2\times 4}{2}\rm =4$,其立体构型为正四面体;
铊$\rm (\text{Tl}\rm )$与$\text{Al}$同族,第一电离能$\text{Tl}$ $\text{Al}\rm ($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。
$\\rm \\lt $
"]]同族元素由上到下第一电离能变小,所以第一电离能$\text{Tl}\rm \lt \text{Al}$;
根据下表中元素的电负性数值判断,$\text{Al}{{\text{F}}_{3}}$为 $\rm ($填“离子化合物”或“共价化合物”,下同$\rm )$,$\text{AlC}{{\text{l}}_{3}}$为 。
| 元素 | $\rm F$ | $\text{Al}$ | $\text{Cl}$ |
| 电负性 | $\rm 4.0$ | $\rm 1.5$ | $\rm 3.0$ |
离子化合物 ;共价化合物
"]]$\text{Al}{{\text{F}}_{3}}$中$\rm Al$、$\rm F$的电负性分别为$\rm 1.5$、$\rm 4.0$,则其电负性差值 为:$\rm 4.0-1.5=2.5\gt 1.7$,则形成离子化合物,所以$\text{Al}{{\text{F}}_{3}}$为离子化合物;$\text{AlC}{{\text{l}}_{3}}$中$\rm Al$、$\rm Cl$的电负性分别为$\rm 1.5$、$\rm 3.0$,则其电负性差值 为:$\rm 3.0-1.5=1.5\lt 1.7$,则形成共价化合物,所以$\text{AlC}{{\text{l}}_{3}}$为共价化合物;
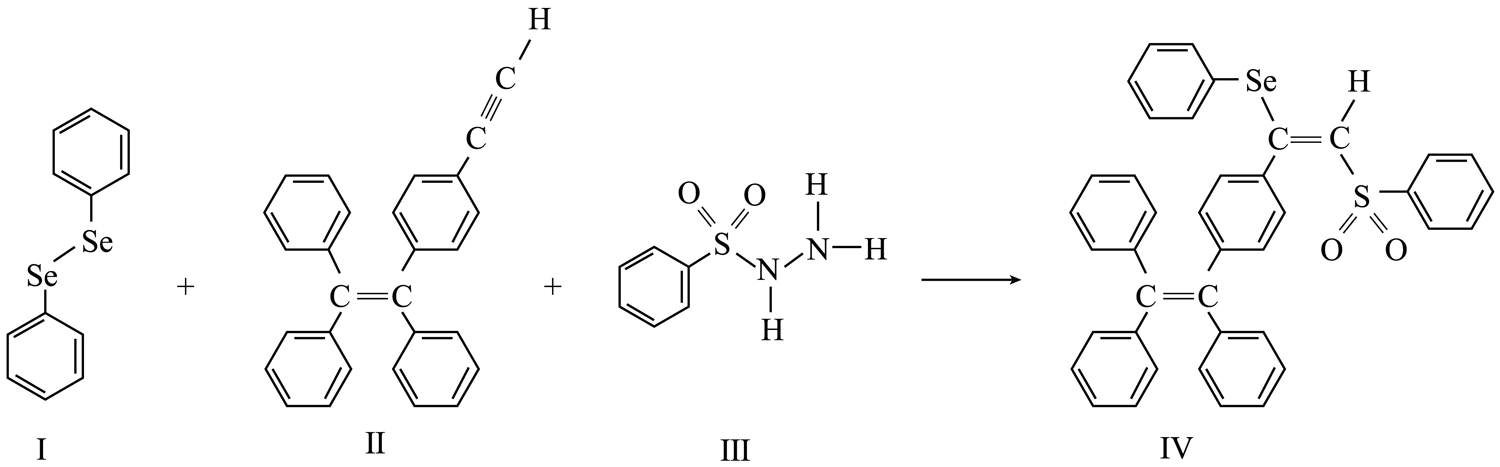
气态$\text{AlC}{{\text{l}}_{3}}$通常以二聚体$\text{A}{{\text{l}}_{2}}\text{C}{{\text{l}}_{6}}$的形式存在,其空间结构如图$\rm a$所示,二聚体中$\text{Al}$的轨道杂化类型为 。$\text{Al}{{\text{F}}_{3}}$结构如图$\rm b$所示,若晶胞参数$\rm ($立方体棱长$\rm )$为${a}\ \text{cm}$,则晶体密度$\rho\!\!\text{ }=$ $\text{g}\cdot \text{c}{{\text{m}}^{-3}}\rm ($列出计算式,阿伏加德罗常数的值为${{{N}}_{\text{A}}}\rm )$。
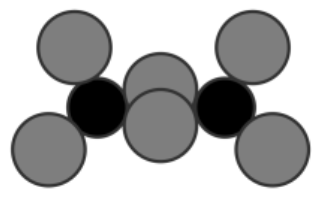 |  |
| 图$\rm a$ | 图$\rm b$ |
$\\rm sp^{3}$; $\\dfrac{84}{{{a}^{3}}{{N}_{\\rm A}}}\\text{g}\\cdot \\text{c}{{\\text{m}}^{-3}}$
"]]二聚体中$\rm Al$形成$\rm 4$个$\sigma $键,轨道杂化类型为$\rm sp^{3}$; 晶体体积为$ a^{3}\;\rm cm^{3}$,一个晶胞中含$\rm Al^{3+}$:$8\times \dfrac{1}{8}\rm =1$个,$\rm F^{-}$:$12\times \dfrac{1}{4}\rm =3$个,晶胞密度为$\dfrac{84}{{{a}^{3}}{{N}_{\rm A}}}\text{g}\cdot \text{c}{{\text{m}}^{-3}}$
高中 | 离子化合物题目答案及解析(完整版)
