高中 | 分子的极性 题目答案及解析
稿件来源:高途
高中 | 分子的极性题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第三节 分子的性质
分子的极性
某化合物结构为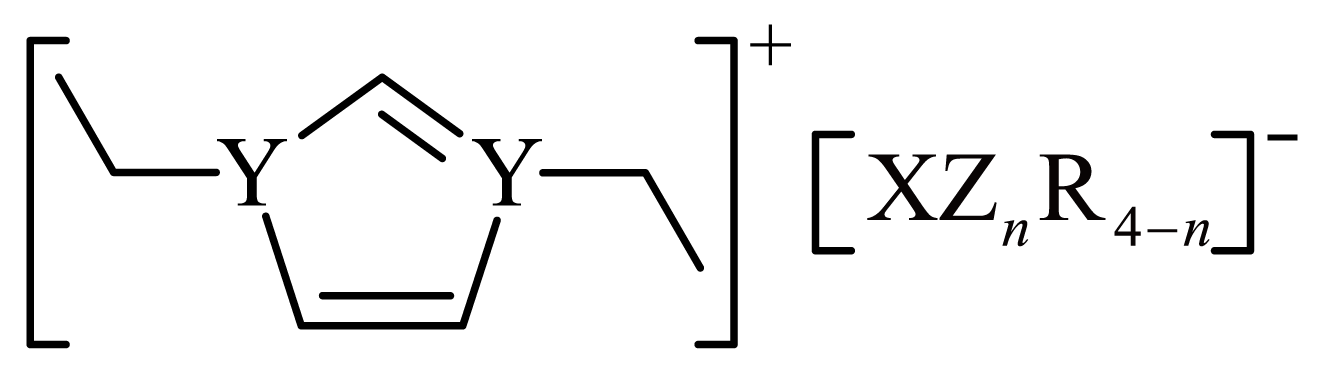 ,元素$\rm Z$、$\rm Y$、$\rm X$、$\rm R$为原子半径依次增大的短周期主族元素,基态$\rm Z$原子的$\text{p}$能级电子总数比$\text{s}$能级电子总数多$\rm 1$,$\rm R$与$\rm Z$同主族,该化合物中两个$\rm Y$原子的杂化方式相同。下列说法错误的是$(\qquad)$
,元素$\rm Z$、$\rm Y$、$\rm X$、$\rm R$为原子半径依次增大的短周期主族元素,基态$\rm Z$原子的$\text{p}$能级电子总数比$\text{s}$能级电子总数多$\rm 1$,$\rm R$与$\rm Z$同主族,该化合物中两个$\rm Y$原子的杂化方式相同。下列说法错误的是$(\qquad)$
分子极性:$\\text{Y}{{\\text{Z}}_{3}}\\gt \\text{X}{{\\text{Z}}_{3}}$
","简单氢化物的酸性和稳定性均为:$\\text{Z}\\lt \\text{R}$
","同周期第一电离能大于$\\rm X$的主族元素有$\\rm 5$种
","该物质中含有离子键、配位键、非极性共价键等化学键
"]由题干信息可知,元素$\rm Z$、$\rm Y$、$\rm X$、$\rm R$为原子半径依次增大的短周期主族元素,基态$\rm Z$原子的$\rm p$能级电子总数比$\rm s$能级电子总数多$\rm 1$,即$\rm 1s^{2}2s^{2}2p^{5}$或$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{1}$,$\rm R$与$\rm Z$同主族,故$\rm Z$只能为$\rm 1s^{2}2s^{2}2p^{5}$即为$\rm F$,$\rm R$为$\rm Cl$,两个$\rm Y$原子的杂化方式相同,即均为$\rm sp^{2}$杂化,且$\rm Y$最形成$\rm 3$个或$\rm 4$个共价键,则$\rm Y$为$\rm N$,由阴离子 ${\rm [XZ}_{n}{\rm R}_{4-n}]^{-}$中$\rm F$和$\rm Cl$均为$\rm -1$价,$\rm X$为$\rm B$,据此分析解题。
$\rm A$.由分析可知,$\rm X$为$\rm B$、$\rm Y$为$\rm N$、$\rm Z$为$\rm F$,则$\rm YZ_{3}$即$\rm NF_{3}$为三角锥形构型,正负电荷中心不重合,是极性分子,而$\rm XZ_{3}$即$\rm BF_{3}$呈平面三角形构型,正负电荷中心重合,为非极性分子,故分子极性$\rm NF_{3}\gt BF_{3}$即$\rm YZ_{3}\gt XZ_{3}$,故$\rm A$正确;
$\rm B$.由分析可知,$\rm Z$为$\rm F$,$\rm R$为$\rm Cl$,其简单氢化物分别为$\rm HF$、$\rm HCl$,酸性$\rm HF\lt HCl$,故$\rm B$错误;
$\rm C$.由分析可知,$\rm X$为$\rm B$,结合同一周期从左往右元素第一电离能呈增大趋势,Ⅱ$\rm A$与Ⅲ$\rm A$、Ⅴ$\rm A$与Ⅵ$\rm A$反常,故同周期第一电离能大于$\rm X$即$\rm B$的主族元素有$\rm Be$、$\rm C$、$\rm N$、$\rm O$、$\rm F$共$\rm 5$种,故$\rm C$正确;
$\rm D$.由题干物质结构式和分析可知,该物质中含有阴、阳离子间的离子键,阴离子中含有$\rm B$和$\rm F^{-}$或$\rm Cl^{-}$之间的配位键,碳原子间的非极性共价键,故$\rm D$正确。
故选:$\rm B$
高中 | 分子的极性题目答案及解析(完整版)
