高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
硼化钛$\rm (\text{Ti}{{\text{B}}_{2}}\rm )$属于六方晶系准金属化合物,强度高、硬度大,用于机械制造领域;五氟化锑$\rm (\text{Sb}{{\text{F}}_{\text{5}}}\rm )$是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣$\rm ($主要含$\text{Ti}{{\text{O}}_{2}}$、$\text{S}{{\text{b}}_{2}}{{\text{O}}_{3}}$、$\text{ZnO}$、$\text{PbO}$、$\text{NiO}$、$\text{CoO}\rm )$为原料制取硼化钛和五氟化锑的流程如图所示。
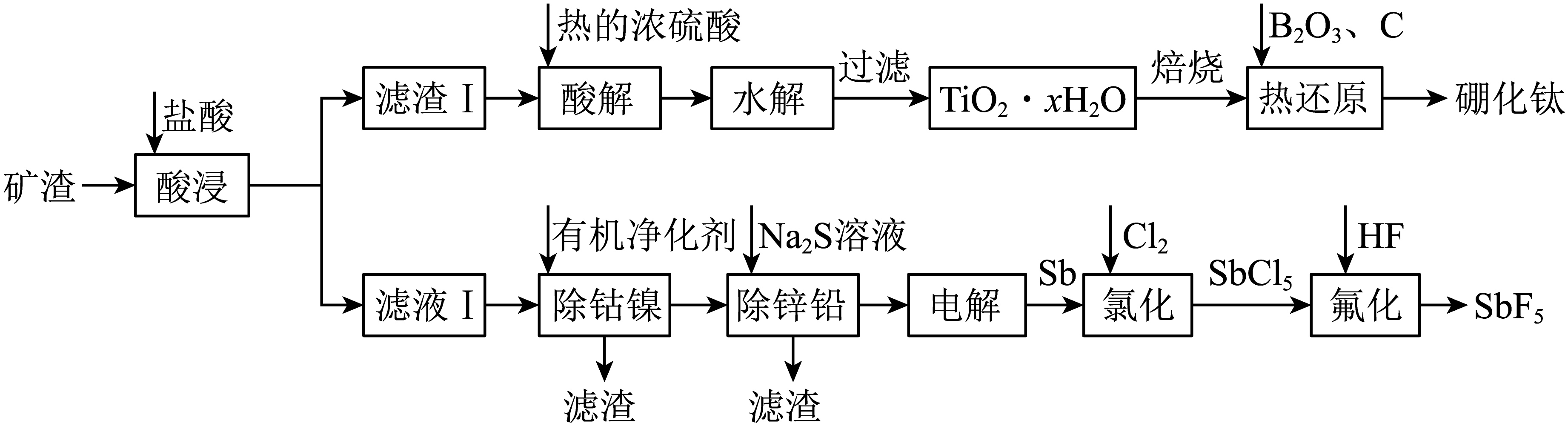
已知:①$\text{Ti}{{\text{O}}_{2}}$性质较稳定,加热时可溶于浓硫酸中形成$\text{Ti}{{\text{O}}^{2+}}$;②高温下${{\text{B}}_{2}}{{\text{O}}_{3}}$易挥发。
回答下列问题:
为了加快酸浸速率,可以采取的措施有 $\rm ($写出两条$\rm )$,滤渣Ⅰ的主要成分是 $\rm ($填化学式$\rm )$。
适当增大盐酸浓度、适当升高酸浸温度$\\rm ($或粉碎矿渣、搅拌等合理$\\rm )$;$\\text{Ti}{{\\text{O}}_{2}}$
"]]根据影响反应速率的因素,为了加快酸浸速率,可以采取的措施有适当增大盐酸浓度、适当升高酸浸温度;$\text{Ti}{{\text{O}}_{2}}$不溶于盐酸,滤渣Ⅰ的主要成分是$\text{Ti}{{\text{O}}_{2}}$。
“热还原”步骤中使用石墨化炉高温加热装置$\rm (1500\sim2100\rm\;^\circ C )$进行加热,产物中得到一种可燃性气体,此步骤主要反应的化学方程式为 ,同时测得${{\text{B}}_{2}}{{\text{O}}_{3}}$的实际用量超过理论计量值,原因是 。
$\\text{Ti}{{\\text{O}}_{2}}+{{\\text{B}}_{2}}{{\\text{O}}_{3}}+5\\text{C}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\text{Ti}{{\\text{B}}_{2}}+5\\text{CO}\\uparrow $;${{\\text{B}}_{2}}{{\\text{O}}_{3}}$在高温下易挥发,反应不充分
"]]“热还原”步骤中$\text{Ti}{{\text{O}}_{2}}$、$\rm B_{2}O_{3}$、$\rm C$粉高温得到$\text{Ti}{{\text{B}}_{2}}$,产物中得到一种可燃性气体,可知该气体为$\rm CO$,此步骤主要反应的化学方程式为$\text{Ti}{{\text{O}}_{2}}+{{\text{B}}_{2}}{{\text{O}}_{3}}+5\text{C}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{Ti}{{\text{B}}_{2}}+5\text{CO}\uparrow $;根据题目信息,高温下${{\text{B}}_{2}}{{\text{O}}_{3}}$易挥发,所以${{\text{B}}_{2}}{{\text{O}}_{3}}$的实际用量超过理论计量值。
“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理如下图所示。$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$能发生上述转化而$\text{Z}{{\text{n}}^{2+}}$不能,推测可能的原因为 。
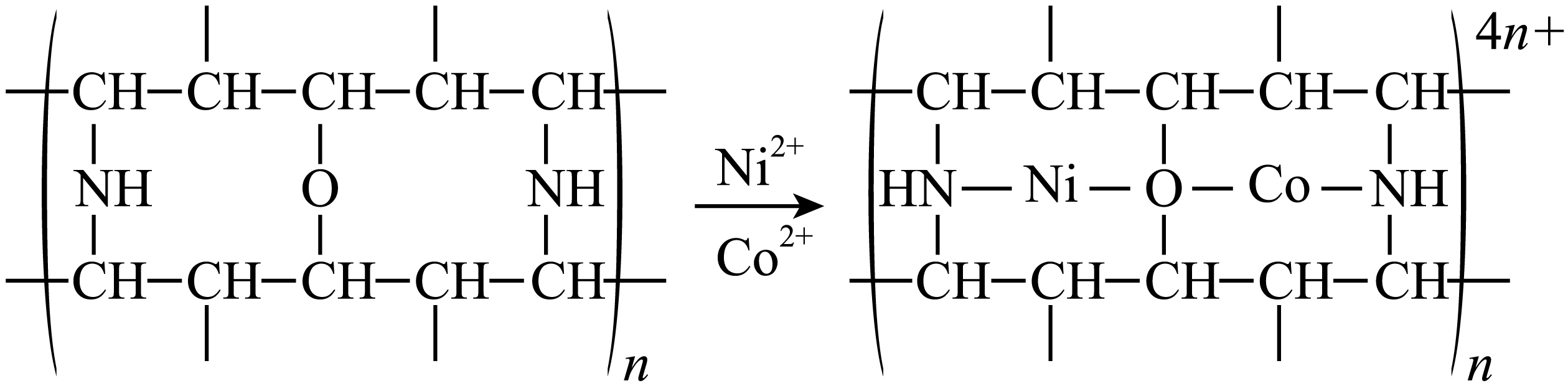
$\\text{C}{{\\text{o}}^{2+}}$、$\\text{N}{{\\text{i}}^{2+}}$半径与有机净化剂网格孔径大小匹配,可形成配位键,而$\\text{Z}{{\\text{n}}^{2+}}$不匹配
"]]根据图示,“除钴镍”步骤中,$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$半径与有机净化剂网格孔径大小匹配,可形成配位键,而$\text{Z}{{\text{n}}^{2+}}$不匹配,所以$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$能发生上述转化而$\text{Z}{{\text{n}}^{2+}}$不能。
硼化钛晶体结构及晶胞沿$z$轴的投影如下图所示,其晶胞参数$ {a}= {b}=0.303\;\rm \text{nm}$,${c}=0.323\;\rm \text{nm}$,$\alpha =\beta =90^\circ$,$\gamma =120{}^\circ $,设阿伏加德罗常数的值为${{N}_{\text{A}}}$。由图可知$\text{B}$的配位数为 ,硼化钛的密度为 $\rm \text{g}/{c}{{\text{m}}^{3}}\rm ($列出计算式即可$\rm )$。
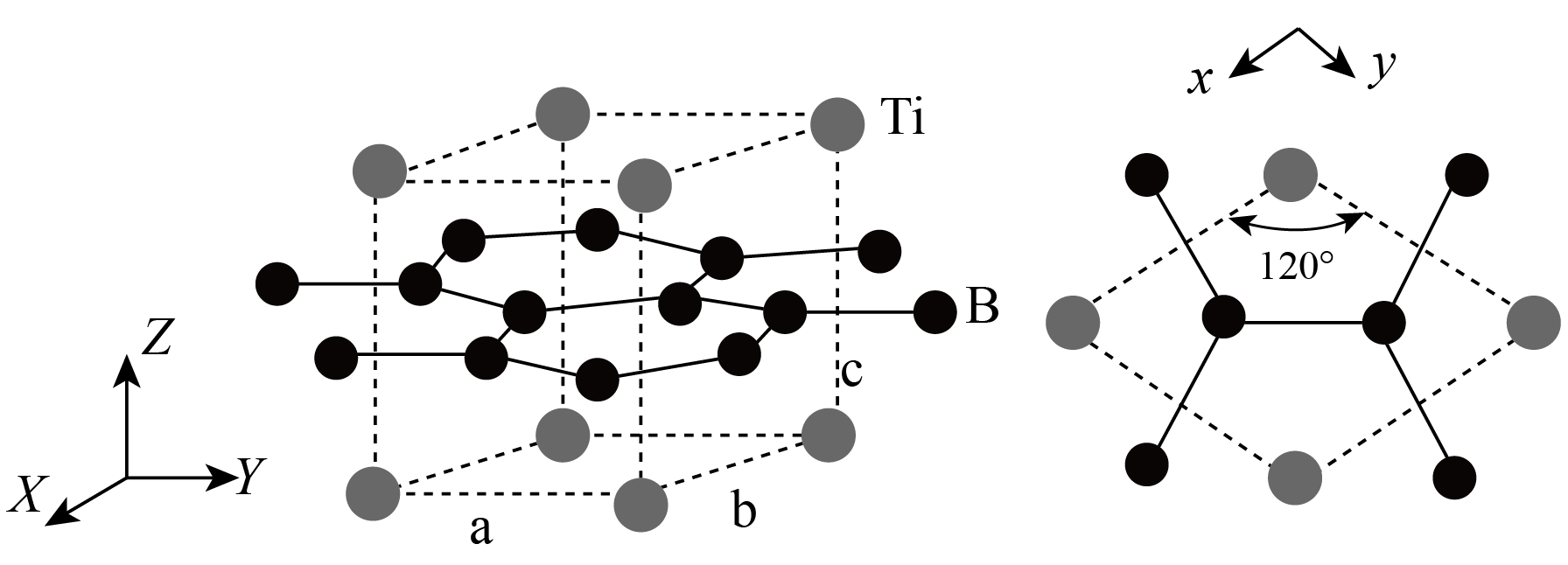
$\\rm 6$;$\\dfrac{48+2\\times 11}{{{N}_{\\text{A}}}\\times \\dfrac{\\sqrt{3}}{2}\\times {{0.303}^{2}}\\times 0.323\\times {{10}^{-21}}}$
"]]硼化钛晶体结构及晶胞沿$z$轴的投影如下图所示,其晶胞参数$ {a}= {b}=0.303\;\rm \text{nm}$,${c}=0.323\;\rm \text{nm}$,$\alpha =\beta =90^\circ$,$\gamma =120{}^\circ $,设阿伏加德罗常数的值为${{N}_{\text{A}}}$。根据图示,$\text{B}$的配位数为$\rm 6$;根据均摊原则,晶胞中$\rm Ti$原子数$\rm 1$,$\rm B$原子数为$\rm 2$,晶胞的体积为$\dfrac{\sqrt{3}}{2}\times {{0.303}^{2}}\times 0.323\times {{10}^{-21}}\;\rm {c}{{\text{m}}^{3}}$,所以硼化钛的密度为$\dfrac{48+2\times 11}{{{N}_{\text{A}}}\times \dfrac{\sqrt{3}}{2}\times {{0.303}^{2}}\times 0.323\times {{10}^{-21}}}\;\rm \text{g}/{c}{{\text{m}}^{3}}$。
高中 | 配合物理论题目答案及解析(完整版)
高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
1、硼化钛属于六方晶系准金属化合物,强度高、硬度大,用于机械制造领域;五氟化锑
是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣
主要含
、
、
、
、
、
为原料制取硼化钛和五氟化锑的流程如图所示。

已知:①性质较稳定,加热时可溶于浓硫酸中形成
;②高温下
易挥发。
回答下列问题:
1.1、为了加快酸浸速率,可以采取的措施有 写出两条
,滤渣Ⅰ的主要成分是
填化学式
。
1.2、“热还原”步骤中使用石墨化炉高温加热装置进行加热,产物中得到一种可燃性气体,此步骤主要反应的化学方程式为 ,同时测得
的实际用量超过理论计量值,原因是 。
1.3、“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理如下图所示。、
能发生上述转化而
不能,推测可能的原因为 。

1.4、硼化钛晶体结构及晶胞沿轴的投影如下图所示,其晶胞参数
,
,
,
,设阿伏加德罗常数的值为
。由图可知
的配位数为 ,硼化钛的密度为
列出计算式即可
。

高中 | 配合物理论题目答案及解析(完整版)
免责声明:
① 凡本站注明“稿件来源:高途”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:高途”,违者本站将依法追究责任。
② 本站注明稿件来源为网络的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。
可作氨选择性催化还原法脱除的催化剂。
下列说法正确的是
二氯化硝基五氨合钴,摩尔质量:是一种难溶于乙醇的棕黄色针状晶体经常用于研究配位化合物内界的键合方式。某实验小组对其进行合成与表征,实验原理及合成步骤如下:
一种新型漂白剂结构如下图可用于漂白羊毛等,其中、、为不同周期不同主族的短周期元素,原子的核外电子排布式为,、、的最外层电子数之和等于的最外层电子数,基态原子核外有两个单电子,、对应的简单离子核外电子排布相同。
卟啉锌超分子在现代农业、科技和国防建设中有着许多独特的用途,其分子结构如图所示。下列关于卟啉锌超分子的说法正确的是
利用锌精矿和软锰矿两种矿料含少量杂质、、等元素的化合物及生产硫酸锌和硫酸锰的流程如下:




