高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
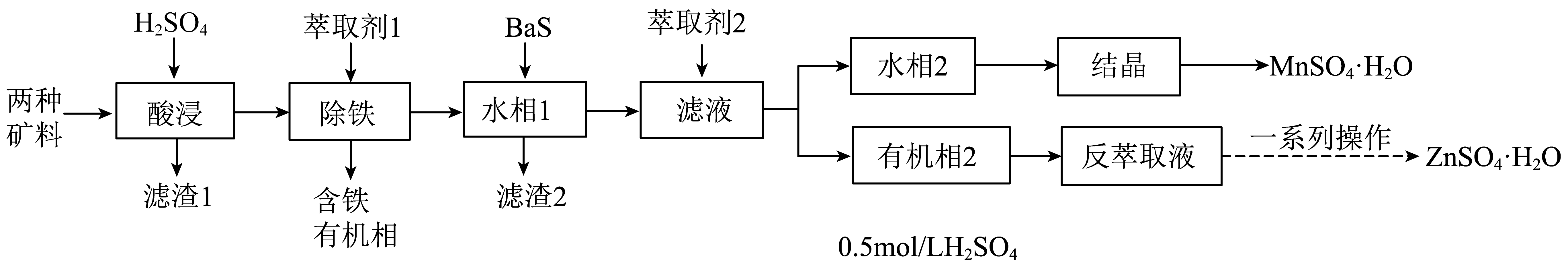
利用锌精矿$\rm (ZnS)$和软锰矿$\rm (MnO_{2})$两种矿料$\rm ($含少量杂质$\rm Fe$、$\rm Cu$、$\rm Pb$等元素的化合物及$\rm SiO_{2})$生产硫酸锌和硫酸锰的流程如下:
 已知常温下:①$\rm H_{2}S$的电离常数为:${{K}_{\text{a1}}}=1.0\text{ }\times {{10}^{-7}}$,${{K}_{\text{a2}}}=1.0\text{ }\times {{10}^{-13}}$;
已知常温下:①$\rm H_{2}S$的电离常数为:${{K}_{\text{a1}}}=1.0\text{ }\times {{10}^{-7}}$,${{K}_{\text{a2}}}=1.0\text{ }\times {{10}^{-13}}$;
②${{K}_{\text{sp}}}\left( \text{ZnS} \right)=1.0\text{ }\times {{10}^{-22}}$,${{K}_{\text{sp}}}\left( \text{MnS} \right)=1.0\text{ }\times {{10}^{-13}}$;
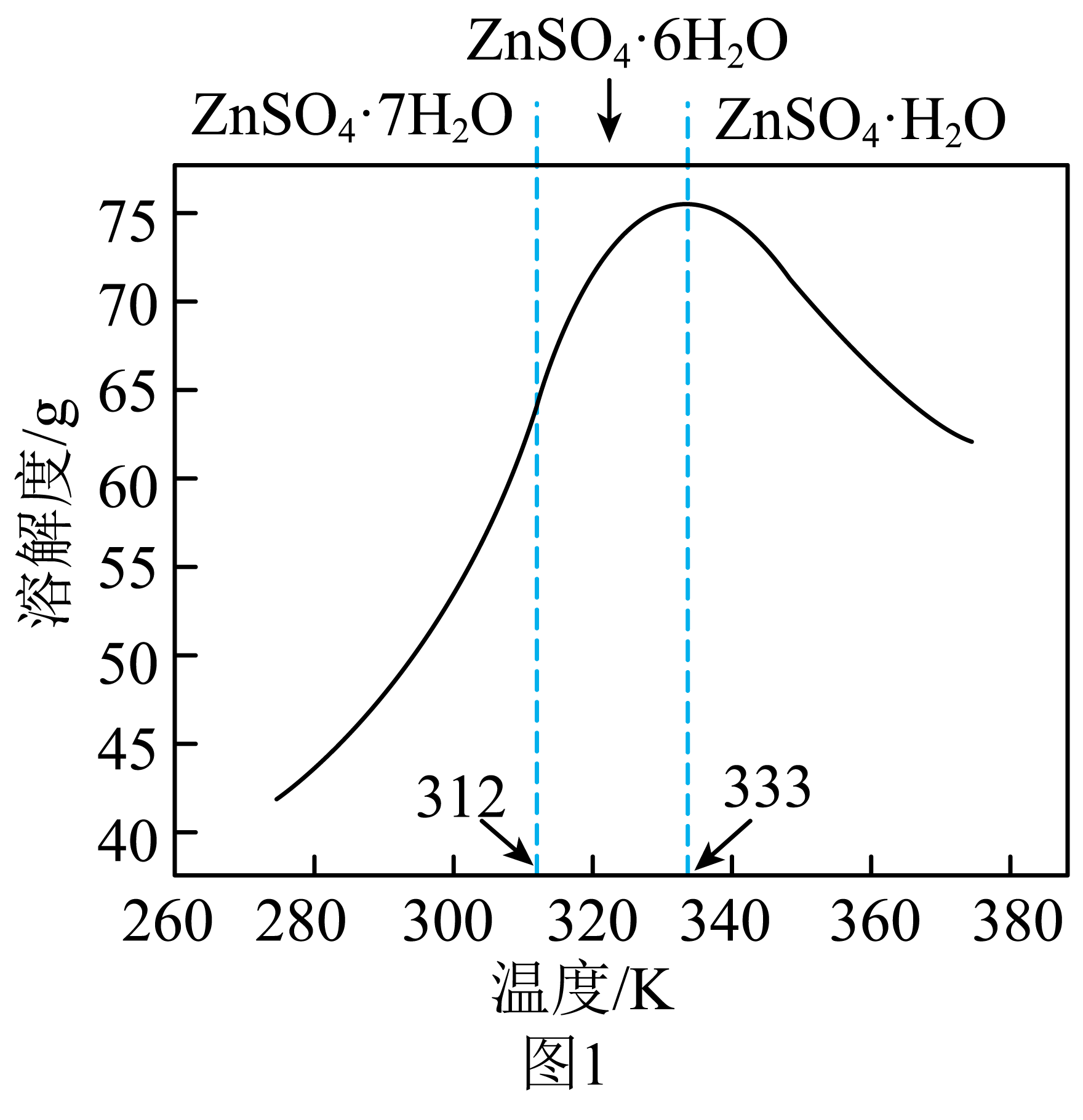
③$\rm ZnSO_{4}$的溶解度如图$\rm 1$所示:
回答下列问题:
基态$\rm S$原子占据最高能级的原子轨道形状为 。
哑铃形
"]]基态$\rm S$原子占据最高能级的原子轨道为$\rm 3p$,形状为哑铃型。
“滤渣$\rm 1$”主要成分为 和硫;写出“酸浸”过程中$\rm MnO_{2}$和$\rm ZnS$反应的化学方程式 。
$\\rm SiO_{2}$、$\\rm PbSO_{4}$ ; $\\rm ZnS+MnO_{2}+2H_{2}SO_{4}=ZnSO_{4}+MnSO_{4}+S↓+2H_{2}O$
"]]加硫酸酸浸,锌、铁、铜、锰生成硫酸盐,硫酸铅为沉淀和二氧化硅一起进入滤渣$\rm 1$;
“酸浸”过程中$\rm MnO_{2}$和$\rm ZnS$反应生成硫单质,化学方程式为:$\rm ZnS+MnO_{2}+2H_{2}SO_{4}=ZnSO_{4}+MnSO_{4}+S↓+2H_{2}O$。
“除铁”的萃取剂为磷酸二$\rm (2-$乙基己基$\rm )$酯$\rm ($用$\rm HA$表示$\rm )$,萃取后含铁的物质为$\rm [Fe(HA)_{2}(H_{2}O)_{2}]ASO_{4}$,该物质中$\rm Fe^{3+}$的配位数为 。
$\\rm 4$
"]]萃取后含铁的物质为$\rm [Fe(HA)_{2}(H_{2}O)_{2}]ASO_{4}$,该物质中$\rm Fe^{3+}$的配位数为$\rm 2+2=4$。
$\rm BaS$为可溶性钡盐。向“水相$\rm 1$”中加入适量$\rm BaS$,发生主要反应的离子方程式为 ;若溶液中$\rm S^{2-}$的浓度控制不当,会造成$\rm Zn^{2+}$、$\rm Mn^{2+}$沉淀而损失,若溶液中$\rm Zn^{2+}$、$\rm Mn^{2+}$的浓度为$\rm 0.10$ $\rm mol·L^{-1}$,则应控制溶液中$c\left( {{\text{H}}^{+}} \right)$不小于 $\rm mol·L^{-1}$。$\rm ($已知溶液中$\rm H_{2}S$的浓度为$\rm 1.0\times 10^{-3}$ $\rm mol/L)$
$\\rm Cu^{2+}+S^{2-}$ $\\rm +Ba^{2+}+\\text{SO}_{\\text{4}}^{\\text{2-}}\\rm =CuS↓+BaSO_{4}↓$ ; $\\rm 0.10$
"]]向“水相$\rm 1$”中加入适量$\rm BaS$,发生主要反应的离子方程式为:$\rm Cu^{2+}+S^{2-}$ $\rm +Ba^{2+}+\text{SO}_{\text{4}}^{\text{2-}}\rm =CuS↓+BaSO_{4}↓$。
若溶液中$\rm S^{2-}$的浓度控制不当,会造成$\rm Zn^{2+}$、$\rm Mn^{2+}$沉淀而损失,若溶液中$\rm Zn^{2+}$、$\rm Mn^{2+}$的浓度为$\rm 0.10$ $\rm mol·L^{-1}$,则应控制溶液中$c\left( {{\text{H}}^{+}} \right)$不小于$\rm 0.10$ $\rm mol·L^{-1}$。
${{K}_{\text{a1}}}{{K}_{\text{a2}}}=\dfrac{{{c}^{\text{2}}}\text{(}{{\text{H}}^{+}}\text{)}c\text{(}{{\text{S}}^{\text{2-}}}\text{)}}{c({{\text{H}}_{\text{2}}}\text{S)}}={{10}^{-20}}$,由${{K}_{\text{sp}}}\left( \text{ZnS} \right)=1.0\text{ }\times {{10}^{-22}}$,${{K}_{\text{sp}}}\left( \text{MnS} \right)=1.0\text{ }\times {{10}^{-13}}$且$\rm Zn^{2+}$、$\rm Mn^{2+}$的浓度为$\rm 0.10$ $\rm mol·L^{-1}$,可知$c\text{(}{{\text{S}}^{\text{2-}}}\text{)}\le 1.0\text{ }\times {{10}^{-23}}$,带入${{K}_{\text{a1}}}{{K}_{\text{a2}}}=\dfrac{{{c}^{\text{2}}}\text{(}{{\text{H}}^{+}}\text{)}c\text{(}{{\text{S}}^{\text{2-}}}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{S)}}={{10}^{-20}}$,可得$c\left( {{\text{H}}^{+}} \right)\ge 0.10\text{ mol/L}$。
从“反萃取液”中获得$\rm ZnSO_{4}·H_{2}O$晶体的操作为:控制温度在 $\rm K$以上,蒸发至有大量固体析出、 、洗涤、干燥。
$\\rm 333$ ; 趁热过滤
"]]观察题图可知应该≥$\rm 333$ $\rm K$,并且趁热过滤。
$\rm ZnSO_{4}·H_{2}O$产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。
$\rm A$.滴定前,锥形瓶和滴定管均须用标准溶液润洗
$\rm B$.将标准溶液装入滴定管时,应借助漏斗转移
$\rm C$.滴定终点时,读取标准液体积时俯视滴定管液面,则测得的体积比实际消耗的小
$\rm D$.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的大
$\\rm CD$
"]]$\rm A$.滴定前,锥形瓶不须用标准溶液润洗,$\rm A$错误;
$\rm B$.将标准溶液装入滴定管时,应借助烧杯转移,$\rm B$错误;
$\rm C$.滴定终点时,读取标准液体积时俯视滴定管液面,则测得的体积比实际消耗的小,$\rm C$正确;
$\rm D$.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的大,$\rm D$正确;
故选:$\rm CD$。
高中 | 配合物理论题目答案及解析(完整版)
