高中 | 偏铝酸盐的化学性质 题目答案及解析
稿件来源:高途
高中 | 偏铝酸盐的化学性质题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
偏铝酸盐的化学性质
某厂废弃的镍催化剂主要含金属$\rm Ni$、$\rm Al$、$\rm Fe$及其氧化物,还有少量其他不溶性物质。采用如图所示工艺流程回收其中的镍制备硫酸镍晶体$\rm (\text{NiS}{{\text{O}}_{4}}\cdot 6{{\text{H}}_{2}}\text{O}\rm )$:
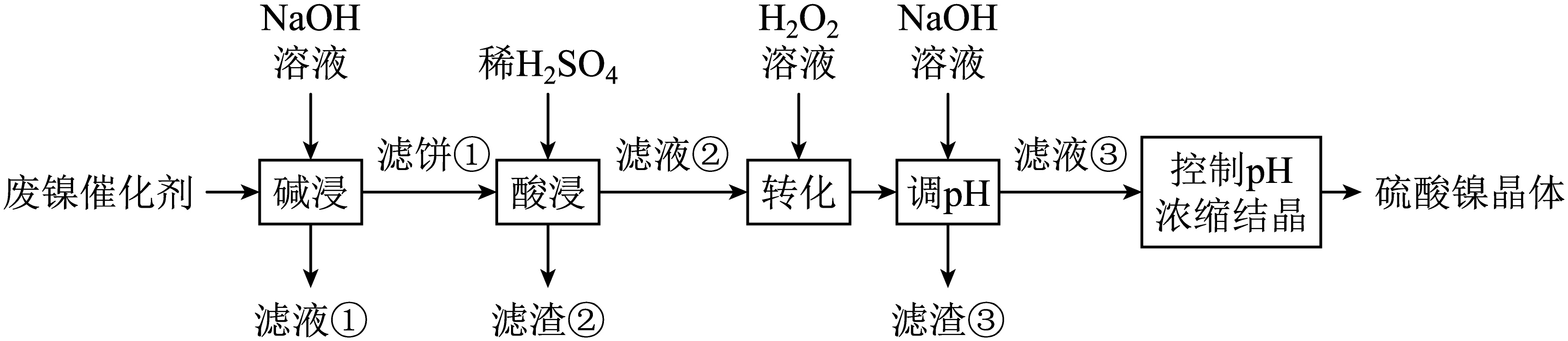
常温下,溶液中金属离子开始沉淀和完全沉淀的$\rm pH$如下表所示:
| 金属离子 | $\text{N}{{\text{i}}^{2+}}$ | $\text{A}{{\text{l}}^{3+}}$ | $\text{F}{{\text{e}}^{3+}}$ | $\text{F}{{\text{e}}^{2+}}$ |
| 开始沉淀时$ (c=0.01\text{ mol}\cdot {{\text{L}}^{-1}}\rm )$的$\rm pH$ | $\rm 7.2$ | $\rm 3.7$ | $\rm 2.2$ | $\rm 7.5$ |
| 沉淀完全时$ (c=1.0\times {{10}^{-5}}\text{ mol}\cdot {{\text{L}}^{-1}}\rm )$的$\rm pH$ | $\rm 8.7$ | $\rm 4.7$ | $\rm 3.2$ | $\rm 9.0$ |
回答下列问题:
“碱浸”时金属单质与$\rm NaOH$溶液发生反应的离子方程式是 。提高“碱浸”速率的措施是 $\rm ($任写一点即可$\rm )$。
$2\\text{Al}+2\\text{O}{{\\text{H}}^{-}}+2{{\\text{H}}_{2}}\\text{O}=2\\text{AlO}_{2}^{-}+3{{\\text{H}}_{2}}\\uparrow $ ; 加热$\\rm ($增大$\\rm NaOH$溶液浓度、粉碎、搅拌等$\\rm )$
"]]由分析可知,“碱浸”时与$\rm NaOH$溶液发生反应的金属单质为$\rm Al$,发生的化学方程式为:$\text{2Al+2NaOH+2}{{\text{H}}_{\text{2}}}\text{O=2NaAl}{{\text{O}}_{\text{2}}}\text{+3}{{\text{H}}_{2}}\uparrow $,则发生反应的离子方程式是:$2\text{Al}+2\text{O}{{\text{H}}^{-}}+2{{\text{H}}_{2}}\text{O}=2\text{AlO}_{2}^{-}+3{{\text{H}}_{2}}\uparrow $;提高“碱浸”速率的措施可以是加热、增大$\rm NaOH$溶液浓度、粉碎、搅拌等。
为回收金属,向“滤液①”通入足量$\text{C}{{\text{O}}_{2}}$,写出反应生成沉淀的离子方程式: 。“滤液②”中含有的金属离子是 。
$\\text{AlO}_{2}^{-}+\\text{C}{{\\text{O}}_{2}}+2{{\\text{H}}_{2}}\\text{O}=\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}\\downarrow +\\text{HCO}_{3}^{-}$ ; $\\text{N}{{\\text{i}}^{2+}}$、$\\text{F}{{\\text{e}}^{2+}}$、$\\text{F}{{\\text{e}}^{3+}}$
"]]滤液①中含有$\text{AlO}_{2}^{-}$,所以通入足量$\text{C}{{\text{O}}_{2}}$,反应生成的沉淀是$\text{Al}{{\left( \text{OH} \right)}_{3}}$,反应的离子方程式为$\text{AlO}_{2}^{-}+\text{C}{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O=Al}{{\left( \text{OH} \right)}_{3}}\downarrow +\text{HCO}_{3}^{-}$;$\rm Ni$、$\rm Fe$及其氧化物不与$\rm NaOH$溶液反应,所以它们存在于滤饼①中,其能与稀硫酸反应,所以滤液②中含有的金属离子有$\text{N}{{\text{i}}^{2+}}$、$\text{F}{{\text{e}}^{2+}}$、$\text{F}{{\text{e}}^{3+}}$。
利用上述表格数据,计算$\text{Ni}{{\left( \text{OH} \right)}_{2}}$的${{K}_{\text{sp}}}=$ 。如果“转化”后的溶液中$\text{N}{{\text{i}}^{2+}}$浓度为$1.0\text{ mol}\cdot {{\text{L}}^{-1}}$,则“调$\rm pH$”应控制的$\rm pH$范围是 。
$1\\times {{10}^{-15.6}}$ ; $3.2\\le \\text{pH}\\lt 6.2$
"]]由表格可知$c\left( \text{N}{{\text{i}}^{2+}} \right)=0.01\text{ mol}\cdot {{\text{L}}^{-1}}$,$\text{pH}=7.2$时开始沉淀,则${{K}_{\text{sp}}}\left[ \text{Ni}{{\left( \text{OH} \right)}_{2}} \right]=0.01\times {{\left( \dfrac{{{10}^{-14}}}{{{10}^{-7.2}}} \right)}^{2}}=1\times {{10}^{-15.6}}$,若“转化”后的溶液中$\text{N}{{\text{i}}^{2+}}$浓度为$\rm 1.0$ $\rm mol/L$,则$c\left( \text{O}{{\text{H}}^{-}} \right)=\sqrt{\dfrac{1\times {{10}^{-15.6}}}{1.0}}={{10}^{-7.8}}\text{ mol/L}$,$c\left( {{\text{H}}^{+}} \right)=\dfrac{{{K}_{\text{w}}}}{c\left( \text{O}{{\text{H}}^{-}} \right)}=\dfrac{{{10}^{-14}}}{{{10}^{-7.8}}}={{10}^{-6.2}}\text{ mol/L}$,此时$\text{pH}=6.2$,再由表格数据可知,当$\text{pH}=3.2$时$\text{F}{{\text{e}}^{3+}}$已经沉淀完全,所以应控制的$\rm pH$范围是$3.2\le \text{pH}\lt 6.2$。
若部分工艺流程改为如图所示,先“调$\rm pH$”后“转化”,“滤液③”中可能含有的杂质离子为 。
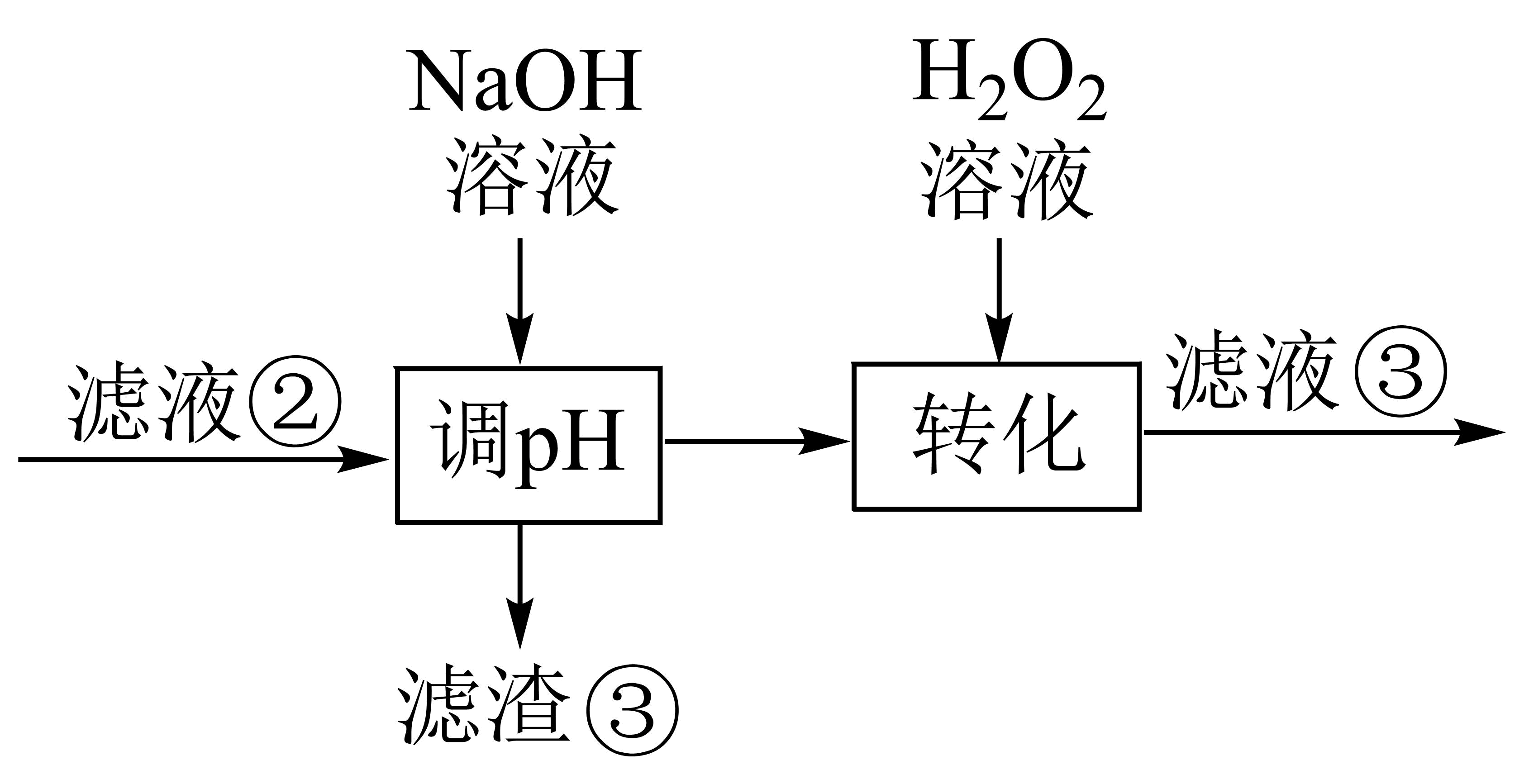
$\\text{F}{{\\text{e}}^{3+}}$
"]]结合金属离子沉淀的$\rm pH$范围可知若将工艺流程改为先“调$\rm pH$”后“转化”,会使调$\rm pH$过滤后的溶液中含有$\text{F}{{\text{e}}^{2+}}$,之后再加${{\text{H}}_{2}}{{\text{O}}_{2}}$氧化$\text{F}{{\text{e}}^{2+}}$,则滤液③中含有转化生成的$\text{F}{{\text{e}}^{3+}}$。
$\text{NiS}{{\text{O}}_{4}}$质量分数随温度变化情况如图所示,已知当$\rm pH$控制在$\rm 3.0$时,结晶得到$\text{NiS}{{\text{O}}_{4}}\cdot 6{{\text{H}}_{2}}\text{O}$晶体外观最符合要求。
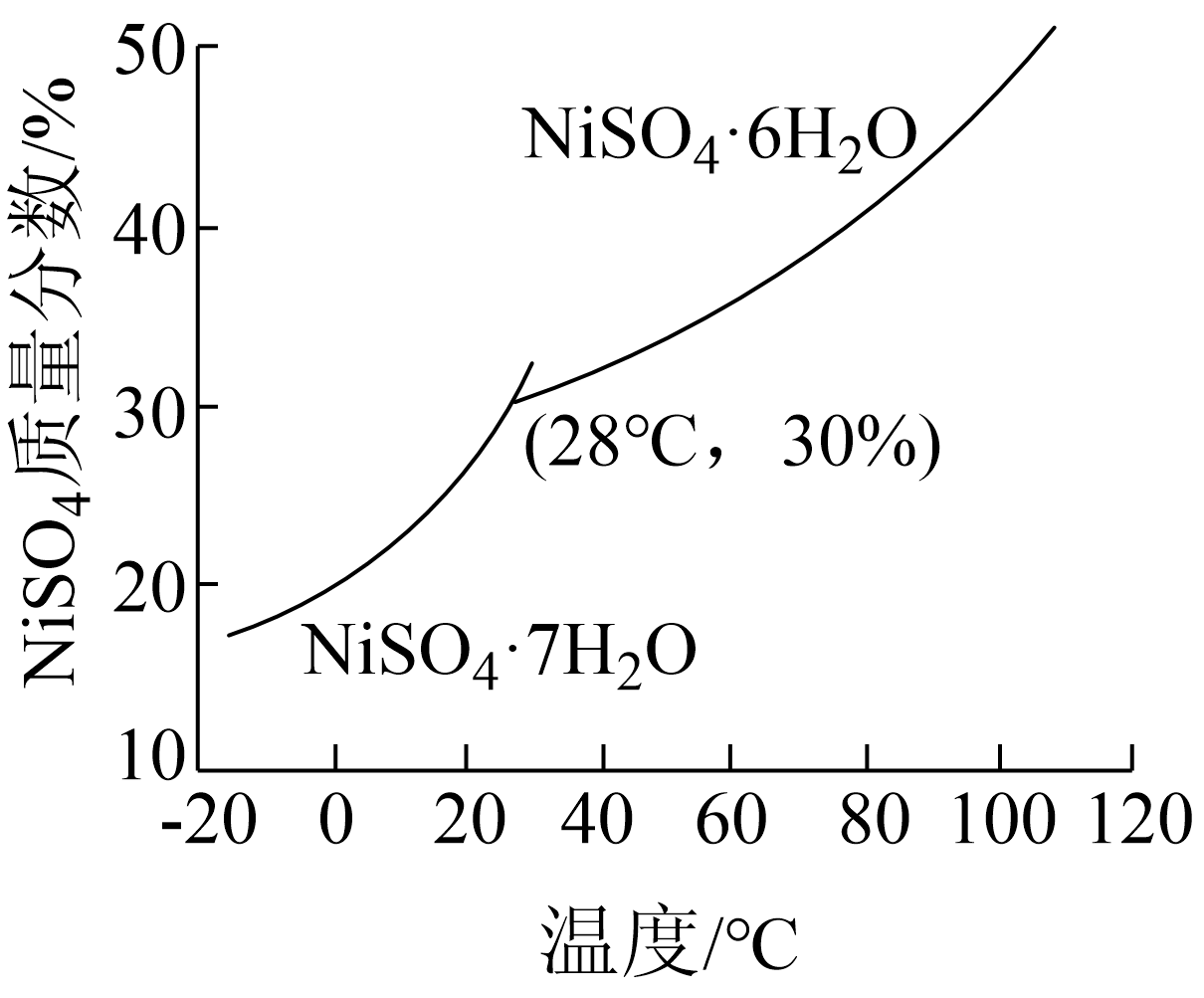
请补充由滤液③得到$\text{NiS}{{\text{O}}_{4}}\cdot 6{{\text{H}}_{2}}\text{O}$晶体的实验方案: ,得到$\text{NiS}{{\text{O}}_{4}}\cdot 6{{\text{H}}_{2}}\text{O}$晶体。$\rm ($实验中须使用的试剂:$1\text{ mol}\cdot {{\text{L}}^{-1}}\ {{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$,乙醇$\rm )$
向滤液中加入$1\\text{ mol}\\cdot {{\\text{L}}^{-1}}\\ {{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}$,控制$\\rm pH$为$\\rm 3.0$,蒸发浓缩,降温至$28\\text{ }{}^\\circ \\text{C}$结晶,趁热过滤,用乙醇洗涤,低温干燥
"]]由图可知,应控制温度在$28\text{ }{}^\circ \text{C}$以上,可得到$\text{NiS}{{\text{O}}_{4}}\cdot 6{{\text{H}}_{2}}\text{O}$,且$\text{NiS}{{\text{O}}_{4}}$易溶于水,不溶于乙醇,可以向滤液中加入$1\text{ mol}\cdot {{\text{L}}^{-1}}\ {{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$,控制$\rm pH$为$\rm 3.0$,蒸发浓缩,降温至$28\text{ }{}^\circ \text{C}$结晶,趁热过滤,用乙醇洗涤,低温干燥。
高中 | 偏铝酸盐的化学性质题目答案及解析(完整版)
