高中 | 乙醇 题目答案及解析
稿件来源:高途
高中 | 乙醇题目答案及解析如下,仅供参考!
选修五
第三章 烃的含氧衍生物
第一节 醇 酚
乙醇
镍镉电池是应用广泛的二次电池,其总反应为:$\text{Cd}+2\text{NiOOH}+2{{\text{H}}_{2}}\text{O} \overset{ 放电}{\underset{ 充电}{\rightleftharpoons}} 2\text{Ni}{{(\text{OH})}_{2}}+\text{Cd}{{(\text{OH})}_{2}}$,制造密封式镍镉电池的部分工艺如下:
Ⅰ$\rm .\text{Ni}{{\left( \text{OH} \right)}_{2}}$的制备
以硫酸镍$\rm (\text{NiS}{{\text{O}}_{4}}\rm )$为原料制备$\text{Ni}{{\left( \text{OH} \right)}_{2}}$的主要过程如下图所示。制备过程中,降低$\text{Ni}{{\left( \text{OH} \right)}_{2}}$沉淀速率,可以避免沉淀团聚,提升电池性能。
![]()
制备过程中,需先加氨水,再加过量$\rm NaOH$,请分析:
①先加氨水的目的是 。
②用化学平衡移动原理分析加入$\rm NaOH$需过量的原因是 。
先加入氨水,可使$\\text{N}{{\\text{i}}^{2+}}$发生反应转化为${{\\left[ \\text{Ni}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{6}} \\right]}^{2+}}$,降低溶液中$\\text{N}{{\\text{i}}^{2+}}$的浓度,再加入$\\rm NaOH$时,可减慢$\\text{Ni}{{\\left( \\text{OH} \\right)}_{2}}$的沉降速率;加入$\\rm NaOH$后,溶液中存在两个平衡,平衡Ⅰ:$\\text{N}{{\\text{i}}^{2+}}(\\text{aq})+2\\text{O}{{\\text{H}}^{-}}(\\text{aq})\\rightleftharpoons \\text{Ni}{{(\\text{OH})}_{2}}(\\text{s})$,平衡Ⅱ:$\\text{N}{{\\text{i}}^{2+}}+6\\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O}\\rightleftharpoons {{\\left[ \\text{Ni}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{6}} \\right]}^{2+}}+6{{\\text{H}}_{2}}\\text{O}$;$\\text{O}{{\\text{H}}^{-}}$过量,使平衡Ⅰ正向移动,溶液中$\\text{N}{{\\text{i}}^{2+}}$的浓度减小,促使平衡Ⅱ逆向移动,从而提高$\\text{Ni}{{\\left( \\text{OH} \\right)}_{2}}$的产率$\\rm ($其他合理答案均可$\\rm )$
"]]从题干已知信息已知:$\rm Ni^{2+}+6NH_{3}\cdot H_{2}O⇌[Ni(NH_{3})_{6}]^{2+}+6H_{2}O$可知;
①先加氨水的目的是先加入氨水,可使$\text{N}{{\text{i}}^{2+}}$发生反应转化为${{\left[ \text{Ni}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{2+}}$,降低溶液中$\text{N}{{\text{i}}^{2+}}$的浓度,再加入$\rm NaOH$时,可减慢$\text{Ni}{{\left( \text{OH} \right)}_{2}}$的沉降速率。
②加入$\rm NaOH$需过量的原因是加入$\rm NaOH$后,溶液中存在两个平衡,平衡Ⅰ:$\rm Ni^{2+}(aq)+2OH^{-}(aq)⇌$ $\rm Ni(OH)_{2}(s)$,平衡Ⅱ:$\rm Ni^{2+}+6NH_{3}\cdot H_{2}O⇌[Ni(NH_{3})_{6}]^{2+}+6H_{2}O$;$\rm OH^{-}$过量,使平衡Ⅰ正向移动,溶液中$\rm Ni^{2+}$的浓度减小,促使平衡Ⅱ逆向移动,从而提高$\rm Ni(OH)_{2}$的产率。
用无水乙醇代替水洗涤滤渣的优点是 $\rm ($答出$\rm 1$条即可$\rm )$。
除去$\\text{Ni}{{\\left( \\text{OH} \\right)}_{2}}$表面的水分$\\rm ($或乙醇易挥发,有利于真空干燥;降低$\\text{Ni}{{\\left( \\text{OH} \\right)}_{2}}$的溶解度$\\rm )$
"]]用无水乙醇代替水洗涤滤渣的优点是除去$\rm Ni(OH)_{2}$表面的水分,乙醇易挥发,有利于真空干燥,降低$\rm Ni(OH)_{2}$的溶解度。
Ⅱ$\rm .$镍镉电池的组装
主要步骤:①将$\text{Ni}{{\left( \text{OH} \right)}_{2}}$和$\text{Cd}{{\left( \text{OH} \right)}_{2}}$固定,中间以隔膜隔开$\rm ($如图所示$\rm )$;②将多组上述结构串联;③向电池中注入$\rm KOH$溶液;④密封。
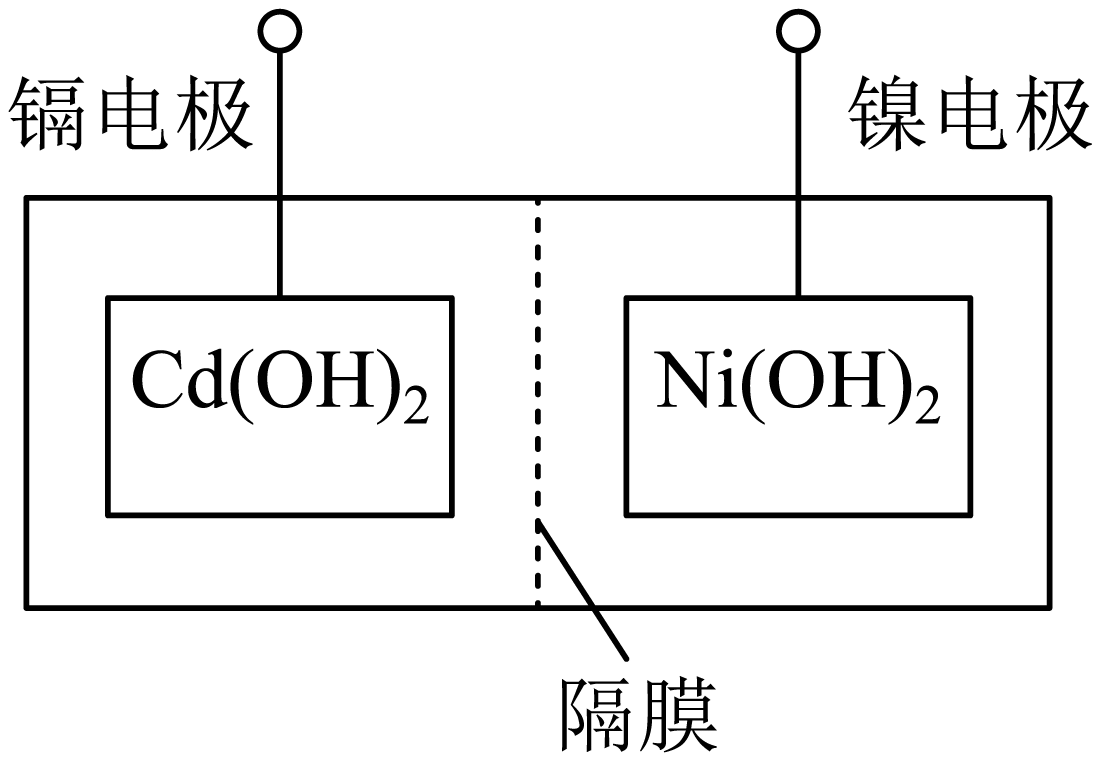
下列对镍镉电池组装和使用的分析正确的是 $\rm ($填字母序号$\rm )$。
$\rm a$.密封镍镉电池可以避免$\rm KOH$变质
$\rm b$.镍电极为电池的负极,镉电极为电池的正极
$\rm c$.电池组装后,应先充电,再使用
$\\rm ac$
"]]$\rm a$.密封镍镉电池可以避免空气中二氧化碳与$\rm KOH$反应生成碳酸钾而变质,$\rm a$项正确;
$\rm b$.通过$\rm Cd+2NiOOH+2H_{2}O\underset{}{\overset{}{\mathop{\rightleftharpoons }}}\,\rm 2Ni(OH)_{2}+Cd(OH)_{2}$可以判断电池的电极,放电时$\rm Cd$是负极,镍电极是正极,$\rm b$项错误;
$\rm c$.电池组装后,应先充电,再使用,$\rm c$项正确。
Ⅲ$\rm .$过度充电的保护
电池充电时,若$\text{Cd}{{\left( \text{OH} \right)}_{2}}$和$\text{Ni}{{\left( \text{OH} \right)}_{2}}$耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的$\text{Cd}{{\left( \text{OH} \right)}_{2}}$可对电池进行过度充电保护,该方法称为镉氧循环法。
$\text{Cd}{{\left( \text{OH} \right)}_{2}}$耗尽后继续充电,镉电极上生成的物质为 。
${{\\text{H}}_{2}}$
"]]$\rm Cd(OH)_{2}$耗尽后继续充电,水中氢离子放电生成氢气,所以镉电极上生成的物质为$\rm H_{2}$。
已知:①隔膜可以透过阴离子和分子;②${{\text{O}}_{2}}$可以与$\rm Cd$发生反应生成$\text{Cd}{{\left( \text{OH} \right)}_{2}}$。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理: 。
过度充电时,由于镉电极$\\text{Cd}{{\\left( \\text{OH} \\right)}_{2}}$过量,阴极电极反应为$2\\text{Cd}{{(\\text{OH})}_{2}}+4{{\\text{e}}^{-}}=2\\text{Cd}+4\\text{O}{{\\text{H}}^{-}}$,避免生成${{\\text{H}}_{2}}$,阳极电极反应为$4\\text{O}{{\\text{H}}^{-}}-4{{\\text{e}}^{-}}={{\\text{O}}_{2}}\\uparrow +2{{\\text{H}}_{2}}\\text{O}$;${{\\text{O}}_{2}}$通过隔膜进入阴极室,与$\\rm Cd$发生反应$2\\text{Cd}+{{\\text{O}}_{2}}+2{{\\text{H}}_{2}}\\text{O}=2\\text{Cd}{{(\\text{OH})}_{2}}$,将阳极生成的${{\\text{O}}_{2}}$消耗,同时生成$\\text{Cd}{{\\left( \\text{OH} \\right)}_{2}}$可继续作为阴极反应物;$\\text{O}{{\\text{H}}^{-}}$透过隔膜进入阳极室补充消耗的$\\text{O}{{\\text{H}}^{-}}$,使反应循环发生
"]]用镉氧循环法实现过度充电保护的原理为过度充电时,由于镉电极$\rm Cd(OH)_{2}$过量,阴极电极反应为$\rm 2Cd(OH)_{2}+4e^{-}=2Cd+4OH^{-}$,避免生成$\rm H_{2}$,阳极电极反应为$\rm 4OH^{-}-4e^{-}=O_{2}↑+2H_{2}O$;$\rm O_{2}$通过隔膜进入阴极室,与$\rm Cd$发生反应$\rm 2Cd+O_{2}+2H_{2}O=2Cd(OH)_{2}$,可继续作为阴极反应物,$\rm OH^{-}$透过隔膜进入阳极室补充消耗的$\rm OH^{-}$,使反应循环发生。
高中 | 乙醇题目答案及解析(完整版)
