高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
研究电解质在水溶液中的离子反应与平衡有重要的意义。
常温时,向$\rm 100\ mL\ 0.1\ {mol} \cdot {L}^{-1}\ N{{H}_{4}}HS{{O}_{4}}$溶液中滴加$\rm 0.1\ {mol} \cdot {L}^{-1}\ NaOH$溶液,得到溶液$\rm pH$与$\rm NaOH$溶液体积的关系曲线如图所示。
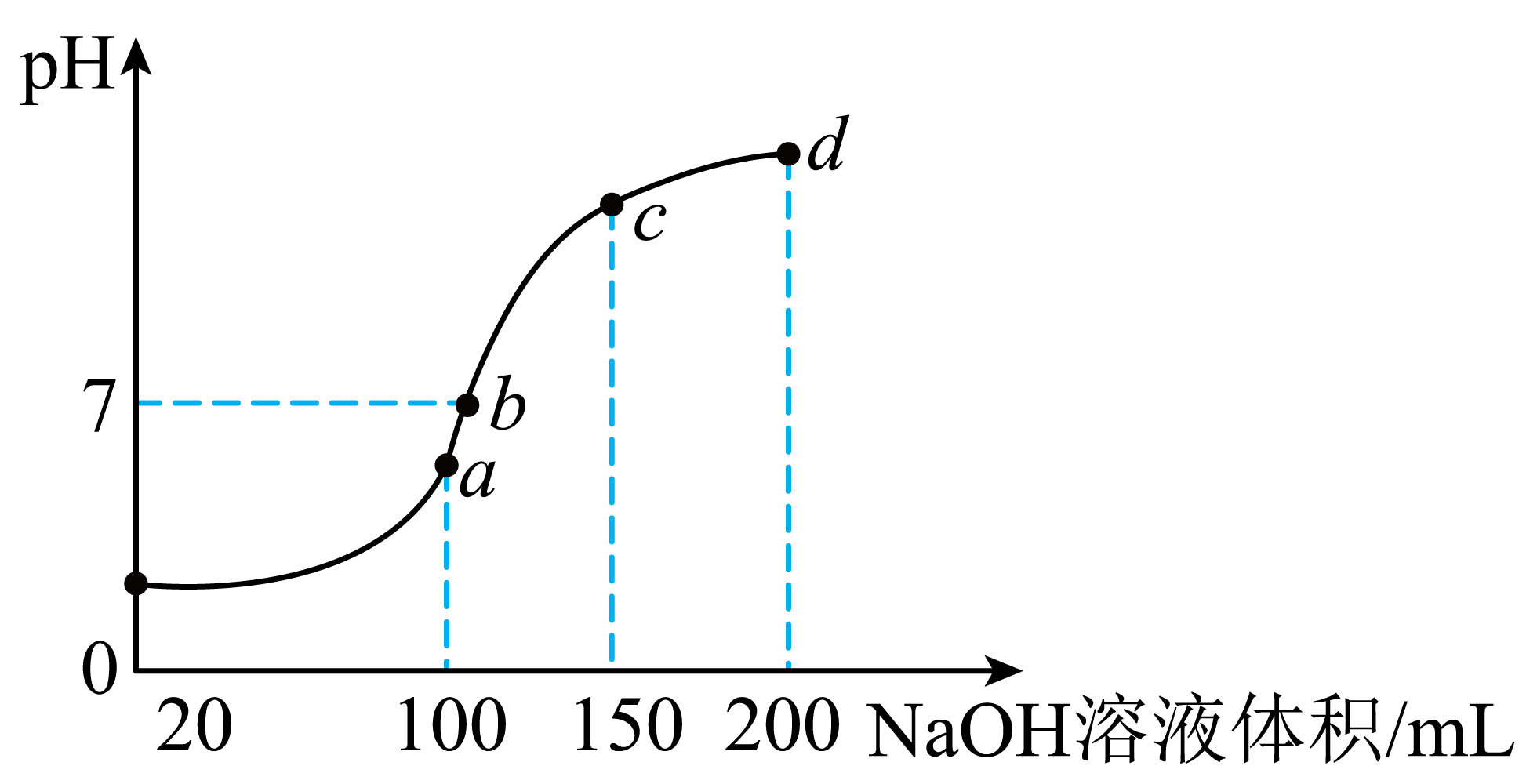
①$\rm N{{H}_{4}}HS{{O}_{4}}$溶液中各离子浓度由大到小的排列顺序是 。
②向$\rm N{{H}_{4}}HS{{O}_{4}}$溶液中滴加$\rm NaOH$溶液到$a$点的过程中,发生反应的离子方程式为 。
③图中$a$、$b$、$c$、$d$四个点中水的电离程度最小的是 。
$c{\\rm ({{H}^{+}})}\\gt c{\\rm (SO_{4}^{2-})}\\gt c{\\rm (NH_{4}^{+})}\\gt c{\\rm (O{{H}^{+}})}$;$\\rm {{H}^{+}}+O{{H}^{-}}={{H}_{2}}O$;$d$
"]]①$\rm NH_{4}HSO_{4}$在水溶液中完全电离生成铵根离子、氢离子和硫酸根离子,其中铵根离子水解生成氢离子,则溶液各离子浓度由大到小的排列顺序为$c{\rm ({{H}^{+}})}\gt c{\rm (SO_{4}^{2-})}\gt c{\rm (NH_{4}^{+})}\gt c{\rm (O{{H}^{+}})}$。
②$\rm 100\ mL\ 0.1\ mol/L$的$\rm NH_{4}HSO_{4}$溶液中加入$\rm 100\ mL\ 0.1\ mol/L$的$\rm NaOH$,此时氢离子和氢氧根离子恰好完全反应,生成硫酸铵和硫酸钠且两者物质的量相等,反应的离子方程式为$\rm {{H}^{+}}+O{{H}^{-}}={{H}_{2}}O$。
③$a$点溶质为硫酸铵和硫酸钠,硫酸铵的存在促进水的电离,继续加入$\rm NaOH$,铵根离子与$\rm OH^{-}$反应生成一水合氨,碱的加入抑制水的电离,且后续随着碱的持续加入,溶液碱性不断增强,对水电离的抑制程度持续增大,因此四点中水的电离程度最小的是$d$。
已知:$\rm 25\ ^\circ \text{C}$时$\rm C{{H}_{3}}COOH$、$\rm {{H}_{2}}C{{O}_{3}}$和$\rm HClO$的电离平衡常数:
| 化学式 | $\rm C{{H}_{3}}COOH$ | $\rm {{H}_{2}}C{{O}_{3}}$ | $\rm HClO$ |
| 电离平衡常数$(K)$ | $\rm 1.75 \times 10^{-5}$ | ${{K}_{{{\rm a}_{1}}}}=4.5\times {{10}^{-7}}$ ${{K}_{\rm a2}}=4.7\times {{10}^{-11}}$ | $\rm 4.0 \times 10^{-8}$ |
①已知$\rm 0.1\ mol/L$的$\rm C{{H}_{3}}COOH$溶液的$\rm pH=3$,用化学用语解释 。
②$\rm 25\ ^\circ \text{C}$时,若初始时醋酸中$\rm C{{H}_{3}}COOH$的物质的量浓度为$\rm 0.01\ mol/L$,达到电离平衡时溶液中$c{\rm ({{H}^{+}})}=$ $\rm \ mol/L$。$\rm ($已知:$\rm \sqrt{17.5}=4.2)$
③$\rm 25\ ^\circ \text{C}$时,等物质的量浓度的$\rm NaClO$溶液和$\rm C{{H}_{3}}COONa$溶液的$\rm pH$关系为:$\rm pH(NaClO)$ $\rm pH(C{{H}_{3}}COONa)($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。
④下列化学反应能发生的是 。
$\rm A$.$\rm HClO+C{{H}_{3}}COONa=C{{H}_{3}}COOH+NaClO$
$\rm B$.$\rm C{{H}_{3}}COOH+N{{a}_{2}}C{{O}_{3}}=NaHC{{O}_{3}}+C{{H}_{3}}COONa$
$\rm C$.$\rm C{{O}_{2}}+{{H}_{2}}O+2NaClO=N{{a}_{2}}C{{O}_{3}}+2HClO$
$\\rm C{{H}_{3}}COO{{H}_{2}}\\rightleftharpoons C{{H}_{3}}CO{{O}^{-}}+{{H}^{+}}$;$\\rm 4.2\\times {{10}^{-4}}$;$\\rm \\gt $;$\\rm B$
"]]①醋酸为弱电解质,不能完全电离,因此$\rm 0.1\ mol/L$的醋酸$\rm pH=3$,用离子方程式可表示为$\rm C{{H}_{3}}COO{{H}_{2}}\rightleftharpoons C{{H}_{3}}CO{{O}^{-}}+{{H}^{+}}$。
②初始醋酸浓度为$\rm 0.01\ mol$,醋酸电离平衡常数为$\rm 1.75\times 10^{-5}$,则有$\dfrac{c{\rm ({{H}^{+}})}\cdot c{\rm (C{{H}_{3}}CO{{O}^{-}})}}{c{\rm (C{{H}_{3}}COOH)}}=1.75\times {{10}^{-5}}$,氢离子浓度等于醋酸根离子浓度,醋酸浓度约为$\rm 0.01\ mol/L$,则氢离子浓度为$\rm \sqrt{1.75\times {{10}^{-7}}}\ mol/L=4.2\times 10^{-4}\ mol/L$。
③醋酸的电离平衡常数大于$\rm HClO$的电离平衡常数,则醋酸根离子的水解程度小于$\rm ClO^{-}$的水解程度,因此等浓度的$\rm NaClO$和$\rm CH_{3}COONa$两种溶液,$\rm NaClO$的$\rm pH$更大。
④$\rm A$.醋酸酸性强于$\rm HClO$,$\rm HClO$无法与醋酸钠反应生成醋酸,$\rm A$错误。
$\rm B$.醋酸酸性强于碳酸氢钠,少量醋酸能与碳酸钠反应生成碳酸氢钠和醋酸钠,$\rm B$正确。
$\rm C$.$\rm HClO$酸性强于$\rm NaHCO_{3}$,弱于碳酸,则$\rm NaClO$溶液中通入二氧化碳,反应生成$\rm NaHCO_{3}$和$\rm HClO$,$\rm C$错误。
利用如图所示装置从海水$\rm ($含$\rm HCO_{3}^{-})$中提取$\rm C{{O}_{2}}$,有利于减少环境温室气体含量。结合化学用语简述提取$\rm C{{O}_{2}}$的原理: 。
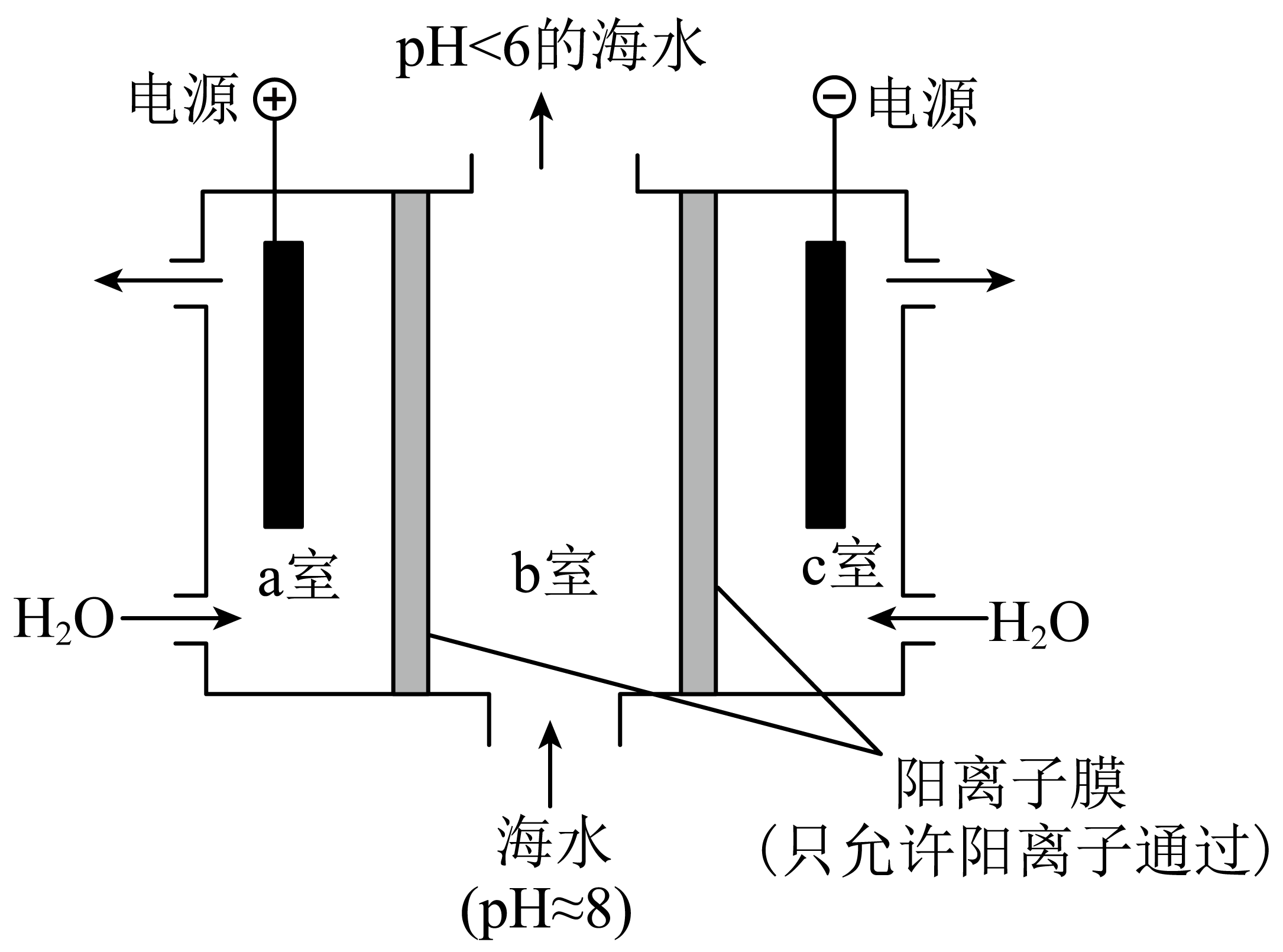
$\\rm a$室:$\\rm 2 {H}_{2} {O}-4 {e}^{-}=4 {H}^{+}+{O}_{2} \\uparrow$,$\\rm {{H}^{+}}$通过阳离子膜进入$\\rm b$室,发生反应:$\\rm {{H}^{+}}+HCO_{3}^{-}=C{{O}_{2}}\\uparrow +{{H}_{2}}O$
"]]从图中可知,$\rm a$电极与电源正极相连为阳极,阳极上水失电子生成氢离子和氧气,$\rm 2 {H}_{2} {O}-4 {e}^{-}=4 {H}^{+}+{O}_{2} \uparrow$,生成的氢离子通过阳离子交换膜进入$\rm b$室,与海水中的碳酸氢根离子反应生成二氧化碳气体,$\rm {{H}^{+}}+HCO_{3}^{-}=C{{O}_{2}}\uparrow +{{H}_{2}}O$。
高中 | 离子方程式题目答案及解析(完整版)
