高中 | 原子晶体 题目答案及解析
稿件来源:高途
高中 | 原子晶体题目答案及解析如下,仅供参考!
选修三
第三章 晶体结构与性质
第二节 分子晶体与原子晶体
原子晶体
甲硅烷$\text{Si}{{\text{H}}_{4}}$可用于制备多种新型无机非金属材料。
$\rm Si$原子与$\rm H$原子结合时,$\rm Si$表现为正价,则电负性:$\rm Si$ $\rm H($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$,$\text{Si}{{\text{H}}_{4}}$分子的空间结构名称为 。
$\\rm \\lt $; 正四面体形
"]]$\rm Si$原子与$\rm H$原子结合时,$\rm Si$表现为正价,则氢吸电子能力更强,故电负性:$\rm Si\lt H$,$\text{Si}{{\text{H}}_{4}}$分子中心原子价层电子对数为$4+\dfrac{1}{2}\left( 4-4\times 1 \right)\rm =4$,且没有孤电子对,空间结构为正四面体形。
利用$\text{Si}{{\text{H}}_{4}}$与$\text{N}{{\text{H}}_{3}}$可制得氮化硅$\rm (\text{S}{{\text{i}}_{3}}{{\text{N}}_{4}}\rm )$材料。$\text{Si}{{\text{H}}_{4}}$中$\text{H}-\text{Si}-\text{H}$的键角 $\text{N}{{\text{H}}_{3}}$中$\text{H}-\text{N}-\text{H}$的键角$\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$,其键角差异的原因是 。
$\\rm \\gt $;$\\text{Si}{{\\text{H}}_{4}}$与$\\text{N}{{\\text{H}}_{3}}$的中心原子均为$\\text{s}{{\\text{p}}^{3}}$杂化,但$\\text{N}{{\\text{H}}_{3}}$中心原子$\\rm N$原子上含有一对孤对电子,$\\text{Si}{{\\text{H}}_{4}}$中心原子$\\rm Si$上无孤电子对。孤对电子与成键电子之间的排斥力强于成键电子与成键电子之间的斥力,导致$\\text{Si}{{\\text{H}}_{4}}$中$\\text{H}-\\text{Si}-\\text{H}$的键角大于$\\text{N}{{\\text{H}}_{3}}$中$\\text{H}-\\text{N}-\\text{H}$的键角
"]]$\text{Si}{{\text{H}}_{4}}$与$\text{N}{{\text{H}}_{3}}$的中心原子均为$\text{s}{{\text{p}}^{3}}$杂化,但$\text{N}{{\text{H}}_{3}}$中心原子$\rm N$原子上含有一对孤对电子,$\text{Si}{{\text{H}}_{4}}$中心原子$\rm Si$上无孤电子对。孤对电子与成键电子之间的排斥力强于成键电子与成键电子之间的斥力,导致$\text{Si}{{\text{H}}_{4}}$中$\text{H}-\text{Si}-\text{H}$的键角大于$\text{N}{{\text{H}}_{3}}$中$\text{H}-\text{N}-\text{H}$的键角。
利用$\text{Si}{{\text{H}}_{4}}$与$\text{C}{{\text{H}}_{4}}$反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
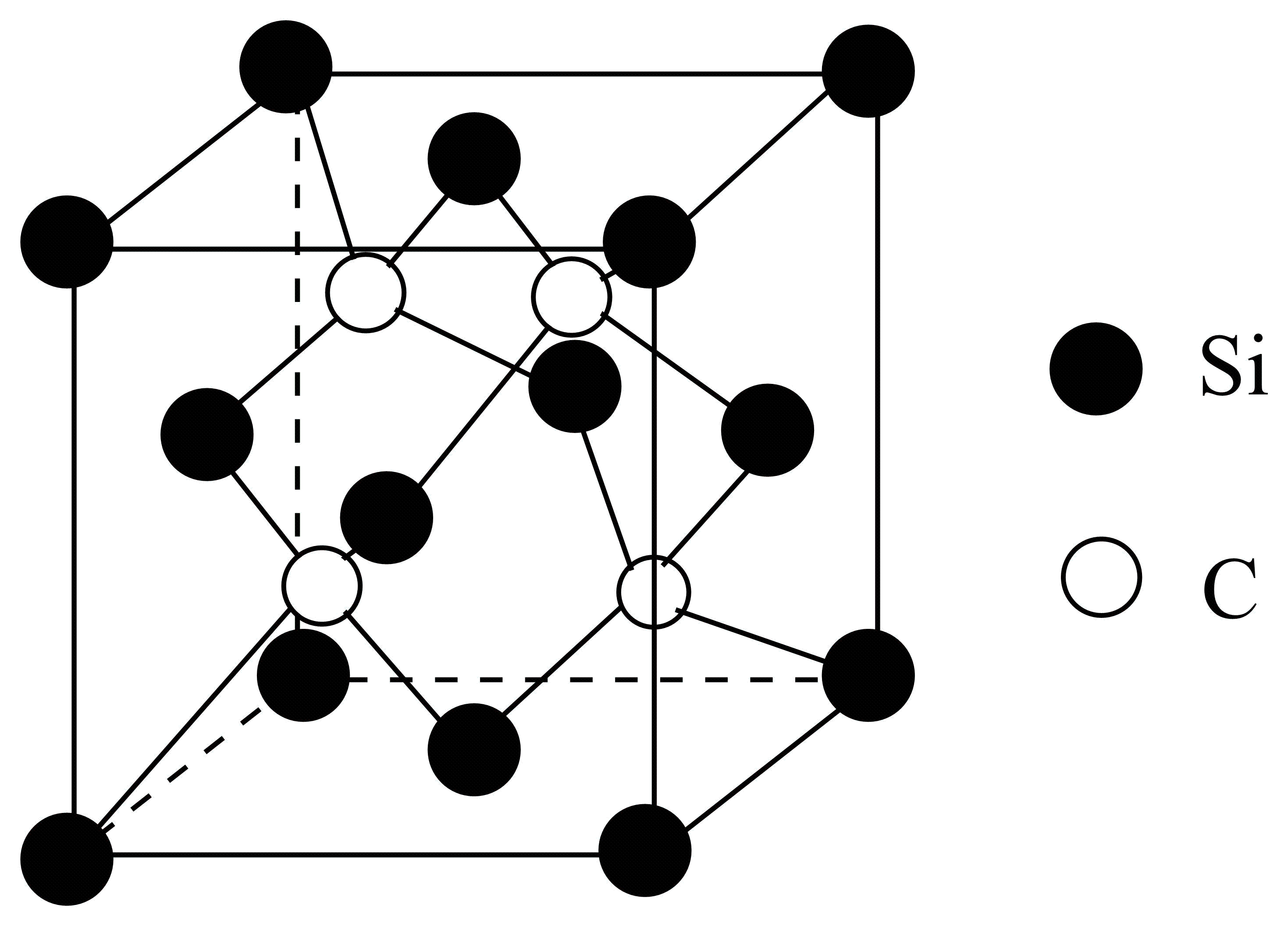
①热稳定性:$\text{Si}{{\text{H}}_{4}}$ $\text{C}{{\text{H}}_{4}}\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
②碳化硅晶体中每个$\rm Si$原子周围距离最近的$\rm C$原子数目为 ,$\rm SiC$的晶体类型是 。
③已知碳化硅的晶胞边长为$a$ $\rm nm(1\text{nm}={{10}^{-9}}\rm m)$,阿伏伽德罗常数为${{N}_{\text{A}}}$。则碳化硅晶体的密度为 $\rm \;\rm g$⋅$\rm cm^{-3}($列出计算式$\rm )$。
④硅、金刚石和碳化硅晶体的熔点从高到低依次是 。
$\\rm \\lt $; $\\rm 4$ ;共价晶体; $\\dfrac{4\\times 40}{{{N}_{\\text{A}}}\\times {{\\left( {a}\\times {{10}^{-7}} \\right)}^{3}}}$ ;金刚石$\\rm \\gt $碳化硅$\\rm \\gt $硅
"]]①$\rm C$原子半径氮小于$\rm Si$,碳氢键长更短、键能更大,则热稳定性:$\text{Si}{{\text{H}}_{4}}\rm \lt \text{C}{{\text{H}}_{4}}$;
②由图可知,碳化硅晶体中每个$\rm Si$原子处于$\rm 4$个碳形成的四面体中,故周围距离最近的$\rm C$原子数目为$\rm 4$,$\rm SiC$的晶体是通过共价键形成的,类型是共价晶体;
③根据“均摊法”,晶胞中含$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$个$\rm Si$、$\rm 4$个$\rm C$,则晶体密度为$\dfrac{\dfrac{{4M}}{{{{N}}_{\text{A}}}}}{{{{a}}^{\text{3}}}}\times \text{1}{{\text{0}}^{\text{21}}}\ \text{g}\cdot \text{c}{{\text{m}}^{-3}}=\dfrac{4\times 40}{{{{a}}^{\text{3}}}{{{N}}_{\text{A}}}}\times \text{1}{{\text{0}}^{\text{21}}}\ \text{g}\cdot \text{c}{{\text{m}}^{-3}}$;
④原子的电子层数越多,其半径越大,即碳的原子半径小于硅;原子的半径越小,其形成共价键键能越大,硅、金刚石和碳化硅晶体均为共价晶体,键能:碳碳键$\rm \gt $碳硅键$\rm \gt $硅硅键,共价晶体的熔点高低与共价键键能有关,故从高到低依次为:金刚石$\rm \gt $碳化硅$\rm \gt $硅。
硅元素最高价氧化物对应的水化物为原硅酸$\rm ({{\text{H}}_{4}}\text{Si}{{\text{O}}_{4}}\rm )$。
资料:原硅酸$\rm ($![]() $\rm )$可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
$\rm )$可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
①原硅酸钠$\rm (\text{N}{{\text{a}}_{4}}\text{Si}{{\text{O}}_{4}}\rm )$溶液吸收空气中的$\text{C}{{\text{O}}_{2}}$会生成${{\text{H}}_{4}}\text{Si}{{\text{O}}_{4}}$,结合元素周期律解释原因: 。
②从结构的角度解释${{\text{H}}_{4}}\text{Si}{{\text{O}}_{4}}$脱水后溶解度降低的原因: 。
$\\rm C$和$\\rm Si$同主族,同主族元素,从上到下,非金属性减弱,非金属性$\\rm C\\gt Si$,空气中的$\\text{C}{{\\text{O}}_{2}}$溶于水形成${{\\text{H}}_{2}}\\text{C}{{\\text{O}}_{3}}$,最高价氧化物对应水化物的酸性${{\\text{H}}_{2}}\\text{C}{{\\text{O}}_{3}}\\gt {{\\text{H}}_{4}}\\text{Si}{{\\text{O}}_{4}}$,故${{\\text{H}}_{2}}\\text{C}{{\\text{O}}_{3}}$可与$\\text{N}{{\\text{a}}_{4}}\\text{Si}{{\\text{O}}_{4}}$反应制${{\\text{H}}_{4}}\\text{Si}{{\\text{O}}_{4}}$; 原硅酸脱水后,羟基相对数量减少,与水形成氢键的数目减少,同时可能发生交联形成空间网状结构
"]]①$\rm C$和$\rm Si$同主族,同主族元素,从上到下,非金属性减弱,非金属性$\rm C\gt Si$,空气中的$\text{C}{{\text{O}}_{2}}$溶于水形成${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$,最高价氧化物对应水化物的酸性${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}\gt {{\text{H}}_{4}}\text{Si}{{\text{O}}_{4}}$,故${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$可与$\text{N}{{\text{a}}_{4}}\text{Si}{{\text{O}}_{4}}$反应制${{\text{H}}_{4}}\text{Si}{{\text{O}}_{4}}$;
②从结构的角度解释${{\text{H}}_{4}}\text{Si}{{\text{O}}_{4}}$脱水后溶解度降低的原因:原硅酸脱水后,羟基相对数量减少,与水形成氢键的数目减少,同时可能发生交联形成空间网状结构。
高中 | 原子晶体题目答案及解析(完整版)
