高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
磷及其化合物在工业生产中起着重要的作用。
磷在元素周期表中的位置是 ;基态磷原子价电子排布式 。
第三周期VA族;$\\rm 3s^{2}3p^{3}$
"]]磷元素的原子序数为15,位于元素周期表第三周期VA族,基态原子的价电子排布式$\rm 3s^{2}3p^{3}$。
磷元素有白磷、黑磷等常见的单质。
①白磷$\rm (P_{4})$是分子晶体,易溶于$\rm CS_{2}$,难溶于水,可能原因是 。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是 (填字母序号)。
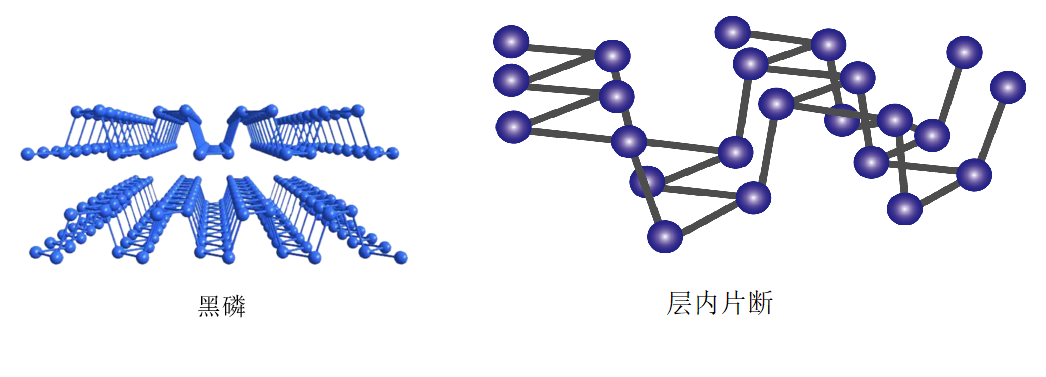
a.黑磷与白磷互为同分异构体
b.黑磷属于混合型晶体
c.黑磷能导电
d.黑磷中磷原子采取$\rm sp^{2}$杂化
$\\rm P_{4}$是非极性分子,$\\rm CS_{2}$是非极性溶剂,$\\rm H_{2}O$是极性溶剂,由相似相溶原理可知,白磷易溶于$\\rm CS_{2}$,难溶于水;bc
"]]①白磷是非极性分子,二硫化碳是非极性溶剂,水分子是极性溶剂,由相似相溶原理可知,白磷易溶于二硫化碳,难溶于水。
②a.黑磷和白磷是磷元素形成的不同种单质,互为同素异形体,不互为同分异构体,故a错误。
b.石墨是混合晶体,由黑磷晶体是与石墨类似的层状结构可知,黑磷晶体是混合型晶体,故b正确。
c.石墨能导电,由黑磷晶体是与石墨类似的层状结构可知,黑磷也能导电,故c正确。
d.由黑磷的层内片段可知,每个磷原子与3个磷原子形成3个$\rm \sigma$键,则磷原子的价层电子对数为4,原子的杂化方式为$\rm sp^{3}$杂化,故d错误。
$\rm Fe^{3+}$与水会形成黄色的配离子$\rm [Fe(OH)]^{2+}$,为避免颜色干扰,常在$\rm Fe^{3+}$溶液中加入$\rm H_{3}PO_{4}$形成无色的$\rm [Fe(PO_{4})_{2}]^{3-}$,此配离子中 (填写化学式)是中心离子,$\rm PO_{4}^{3-}$空间构型是 。
$\\rm Fe^{3+}$;正四面体形
"]]由化学式可知,配离子的中心离子为$\rm Fe^{3+}$、配体为$\rm PO_{4}^{3-}$,配位数为2;$\rm PO_{4}^{3-}$中磷原子的价层电子对数为4、孤对电子对数为0,则磷酸根离子的空间构型为正四面体形。
第$\rm IIIA$族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟的熔点分别为$\rm 2000\ ^\circ C$、$\rm 1070\ ^\circ C$,从结构角度说明其熔点差异的原因 。
②磷化硼是一种半导体材料,晶胞结构如图所示,磷化硼的化学式是 。
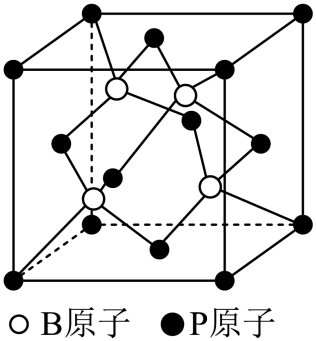
磷化铝和磷化铟属于共价晶体,原子半径:$\\rm Al\\lt In$,共价键键长:$\\rm Al-$$\\rm P\\lt In$$\\rm -P$,则$\\rm Al-P$键强于$\\rm In-P$键,所以$\\rm AlP$熔点高于$\\rm InP$;$\\rm BP$
"]]①由磷化铝和磷化铟的熔点分别为$\rm 2000\ ^\circ C$、$\rm 1070\ ^\circ C$可知,磷化铝和磷化铟是熔点高的共价晶体,同主族元素,从上到下,原子半径依次增大,则原子半径:$\rm Al\lt In$,共价键键长:$\rm Al-P\lt In$$\rm -P$,$\rm Al-P$键强于$\rm In-P$键,共价键越强,共价晶体的熔点越高,所以磷化铝熔点高于磷化铟。
②由晶胞结构可知,晶胞中位于顶点和面心的磷原子个数为$\rm 8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$,位于体内的硼原子个数为$\rm 4$,则磷化硼的化学式为$\rm BP$。
高中 | 杂化轨道理论题目答案及解析(完整版)
