| 杂化轨道理论 题目答案及解析
稿件来源:高途
| 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
高二化学组组织同学们制作晶体模型。$\rm 8$班张宇涵同学提交了金刚石的晶体结构模型,$\rm 17$班路雪同学提交了氯化钠的晶胞模型,如下图所示。下列说法不正确的是$(\qquad)$
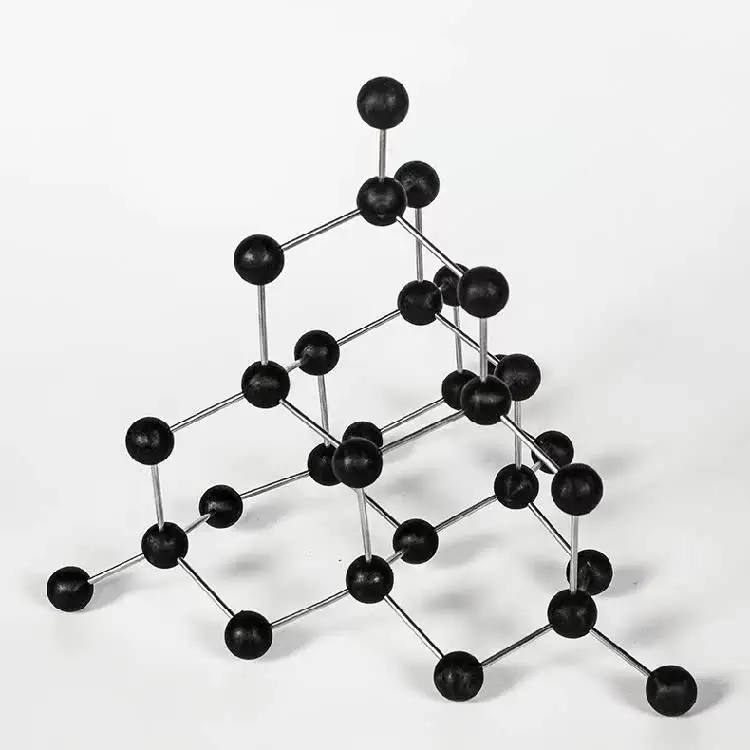

金刚石晶体中,碳原子采取$\\text{s}{{\\text{p}}^{3}}$杂化轨道成键,形成共价键三维骨架网络
","$1\\;\\rm \\text{mol}$金刚石晶体中含$4\\text{ mol C}-\\text{C}$键
","氯化钠晶体中,$\\rm 1$个$\\text{C}{{\\text{l}}^{-}}$周围有$\\rm 12$个距离最近且相等的$\\text{C}{{\\text{l}}^{-}}$
","氯化钠晶胞为立方体,若棱长为$ {a\\;\\rm nm}$,则晶体密度为$\\dfrac{234\\times {{10}^{21}}}{{{ {N}}_{\\text{A}}}{{ {a}}^{3}}}\\;\\rm g\\cdot \\text{c}{{\\text{m}}^{-3}}$
"]$\rm A$.金刚石晶体中,每个碳原子形成三个单键,碳原子采取$\text{s}{{\text{p}}^{3}}$杂化轨道成键,形成共价键三维骨架网络,故$\rm A$正确;
$\rm B$.金刚石晶体结构为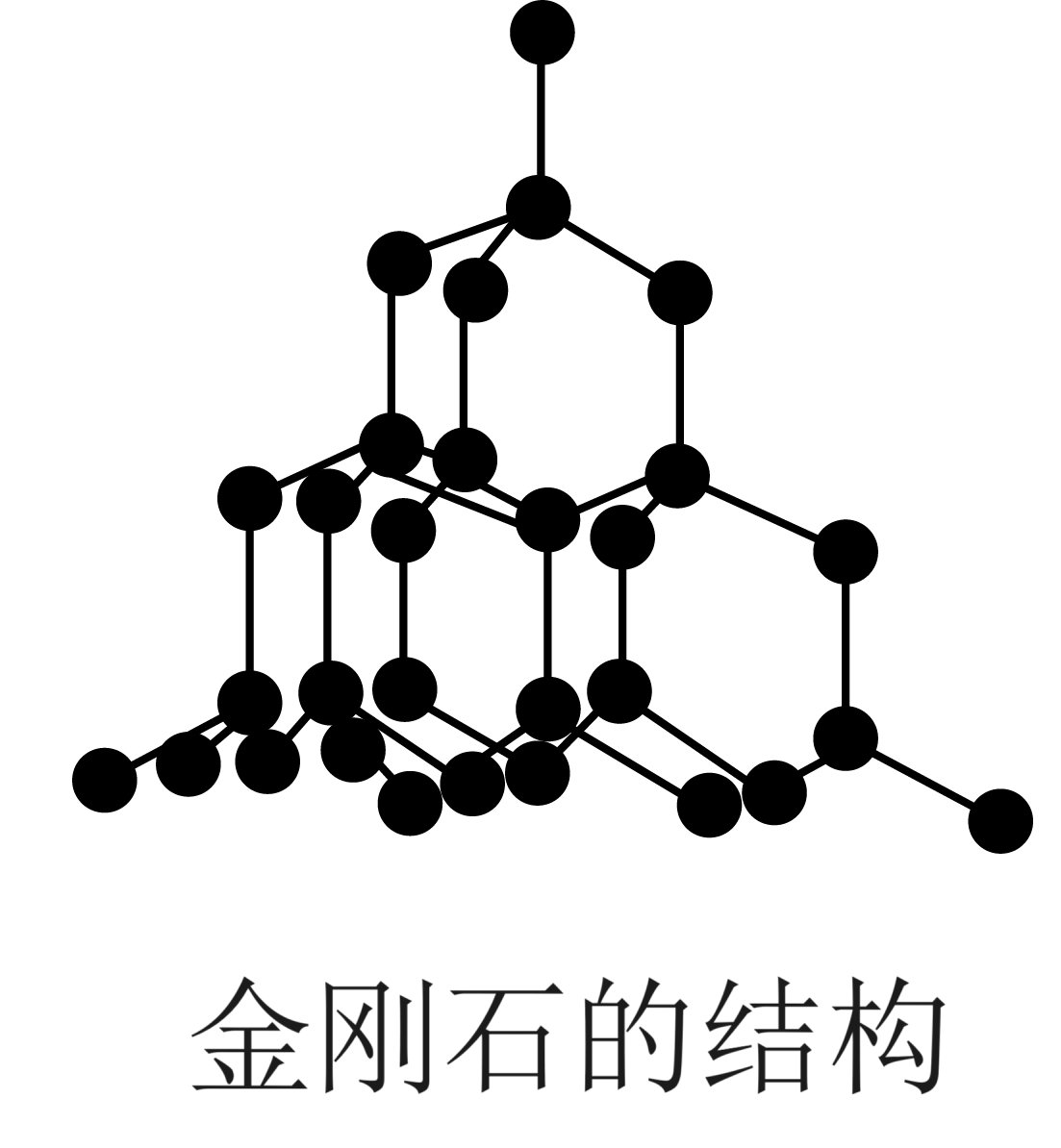 ,根据图知,$\rm 1\;\rm mol$金刚石含$\rm 2\;\rm mol$ $\rm C-C$键,故$\rm B$错误;
,根据图知,$\rm 1\;\rm mol$金刚石含$\rm 2\;\rm mol$ $\rm C-C$键,故$\rm B$错误;
$\rm C$.在氯化钠晶体中,每个$\text{N}{{\text{a}}^{+}}$周围与它距离最近且相等的$\text{N}{{\text{a}}^{+}}$共有$\rm 12$个,每个$\text{C}{{\text{l}}^{-}}$周围与它距离最近且相等的$\text{C}{{\text{l}}^{-}}$共有$\rm 12$个,故$\rm C$正确;
$\rm D$.氯化钠晶胞为立方体,若棱长为$ {a\;\rm nm}$,该晶胞中$\text{C}{{\text{l}}^{-}}$为$6\times \dfrac{1}{2}+8\times \dfrac{1}{8}=4$,$\text{N}{{\text{a}}^{+}}$为$1+12\times \dfrac{1}{4}=4$,则晶体密度为$\rho =\dfrac{m}{V}=\dfrac{234\times {{10}^{21}}}{{{ {N}}_{\text{A}}}{{ {a}}^{3}}}\;\rm g\cdot \text{c}{{\text{m}}^{-3}}$,故$\rm D$正确。
故选:$\rm B$
| 杂化轨道理论题目答案及解析(完整版)
