| 化学反应热的计算 题目答案及解析
稿件来源:高途
| 化学反应热的计算题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
化学反应热的计算
回答下列问题。
现有下列物质:①熔融的$\rm NaCl$ ②稀硫酸 ③氨水 ④冰醋酸 ⑤铜 ⑥$\rm BaSO_{4}$ ⑦$\rm NaHCO_{3}$ ⑧液氨 ⑨$\rm SO_{2}$ ⑩$\rm Ba(OH)_{2}$固体。以上物质中属于弱电解质的是 $\rm ($填数字序号$\rm )$。
④
"]]由分析可知,以上物质中属于弱电解质的是④;
可以证明醋酸是弱酸的事实是 $\rm ($填字母序号$\rm )$。
$\rm a$.醋酸和水能以任意比例混溶
$\rm b$.在醋酸水溶液中还含有未电离的醋酸分子
$\rm c$.醋酸与$\rm Na_{2}CO_{3}$溶液反应放出$\rm CO_{2}$气体
$\rm d$.$\rm 1\;\rm mol·L^{-1}$的醋酸水溶液能使紫色石蕊溶液变红色
$\rm e$.等体积等$c\rm (H^{+})$的醋酸和盐酸分别与足量同浓度氢氧化钠溶液充分反应,醋酸消耗氢氧化钠的体积更大
$\\rm be$
"]]$\rm a$.醋酸和水能以任意比例混溶,说明醋酸的溶解性强,不能说明醋酸部分电离,则不能说明醋酸是弱酸,故$\rm a$错误;
$\rm b$.在醋酸水溶液中还含有未电离的醋酸分子,说明醋酸部分电离,为弱酸,故$\rm b$正确;
$\rm c$.醋酸与$\rm Na_{2}CO_{3}$溶液反应放出$\rm CO_{2}$气体,说明醋酸的酸性大于碳酸,碳酸是弱酸,不能说明醋酸部分电离,则不能说明醋酸是弱酸,故$\rm c$错误;
$\rm d$.$\rm 1\;\rm mol·L^{-1}$的醋酸水溶液能使紫色石蕊溶液变红色,说明醋酸电离出氢离子而使溶液呈酸性,不能说明醋酸部分电离,则不能说明醋酸是弱酸,故$\rm d$错误;
$\rm e$.等体积等$c\rm (H^{+})$的醋酸和盐酸分别与足量同浓度氢氧化钠溶液充分反应,醋酸消耗氢氧化钠的体积更大,则醋酸的物质的量浓度大于盐酸,$\rm HCI$是强电解质,完全电离,则醋酸部分电离,为弱酸,故$\rm e$正确。
$\rm H_{2}$和$\rm I_{2}$在一定条件下能发生反应:${{\text{H}}_{2}}\left( \text{g} \right)+{{\text{I}}_{2}}\left( \text{g} \right)=2\text{HI}\left( \text{g} \right)\qquad\Delta H=-a\; \mathrm{kJ} / \mathrm{mol}$
已知:
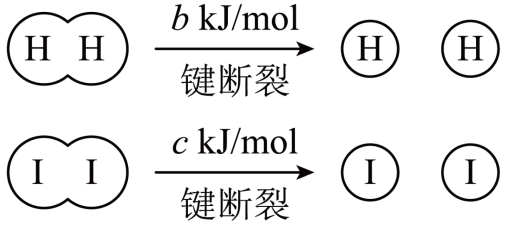
$a$、$b$、$c$均大于零
断开$\rm 1\;\rm mol\;\rm H-I$键所需能量为 $\rm \;\rm kJ$。
$\\dfrac{{a}+{b}+{c}}{2}$
"]]焓变等于反应物的总键能$\rm -$生物的总键能,设$\rm H-I$键所需能量为$x$,则$ {b\;\rm kJ/mol}+{c\;\rm kJ/mol}-2x=-a\;\rm kJ/mol$,解得:$ x=\dfrac{{a+b+c}}{{2}}\rm \;\rm kJ/mol$,则断开$\rm 1\;\rm mol\;\rm \rm H-I$键所需能量为$\dfrac{{a+b+c}}{{2}}\;\rm \rm kJ$;
已知:$\rm Na_{2}S_{2}O_{3}+H_{2}SO_{4}=Na_{2}SO_{4}+SO_{2}↑+S↓+H_{2}O$,进行下列实验,观察出现浑浊的时间。
| 实验 | 温度$\rm /^\circ\rm C$ | $\rm Na_{2}S_{2}O_{3}$溶液 | 稀$\rm H_{2}SO_{4}$ | $\rm H_{2}O$ | ||
| $ V\rm/(mL)$ | $ c\rm/(mol·L^{-1})$ | $ V\rm/(mL)$ | $ c\rm/(mol·L^{-1})$ | $ V\rm/(mL)$ | ||
| $\rm A$ | $\rm 25$ | $\rm 5$ | $\rm 0.1$ | $\rm 10$ | $\rm 0.1$ | $\rm 5$ |
| $\rm B$ | $\rm 25$ | $\rm 5$ | $\rm 0.2$ | $\rm 5$ | $\rm 0.2$ | $\rm 10$ |
| $\rm C$ | $\rm 35$ | $\rm 5$ | $\rm 0.1$ | $\rm 10$ | $\rm 0.1$ | $\rm 5$ |
| $\rm D$ | $\rm 35$ | $\rm 5$ | $\rm 0.2$ | $\rm 5$ | $\rm 0.2$ | $\rm 10$ |
$\rm C$、$\rm D$两组实验的目的是 。
在相同温度下,探究浓度对反应速率的影响
"]]由表格数据可知, $\rm C$、$\rm D$两组实验的目的是在相同温度下,探究浓度对反应速率的影响;
在温度$t_{1}$和$t_{2}$下,$\rm X_{2}(g)$和$\rm H_{2}(g)$反应生成$\rm HX(g)$的平衡常数如下表:
| 化学方程式 | $ K(t_{1})$ | $ K(t_{2})$ |
| $\rm F_{2}+H_{2}\rightleftharpoons \rm 2HF$ | $\rm 1.8\times 10^{36}$ | $\rm 1.9\times 10^{32}$ |
| $\rm Cl_{2}+H_{2}\rightleftharpoons \rm 2HCl$ | $\rm 9.7\times 10^{12}$ | $\rm 4.2\times 10^{11}$ |
| $\rm Br_{2}+H_{2}\rightleftharpoons \rm 2HBr$ | $\rm 5.6\times 10^{7}$ | $\rm 9.3\times 10^{6}$ |
| $\rm I_{2}+H_{2}\rightleftharpoons \rm 2HI$ | $\rm 43$ | $\rm 34$ |
① 已知$t_{2}\gt t_{1}$,$\rm HX$的生成反应是 反应$\rm ($填“吸热”或“放热”$\rm )$。
② 仅依据$K$的变化,可以推断出:随着卤素原子核电荷数的增加, $\rm ($选填字母$\rm )$。
$\rm a$.在相同条件下,平衡时$\rm X_{2}$的转化率逐渐降低 $\rm b$.$\rm HX$的还原性逐渐减弱
$\rm c$.$\rm X_{2}$与$\rm H_{2}$反应的剧烈程度逐渐减弱 $\rm d$.$\rm HX$的稳定性逐渐减弱
放热反应;$\\rm ad$
"]]①由表中数据可知,温度越高平衡常数越小,这说明升高温度平衡向逆反应方向移动,所以$\rm HX$的生成反应是放热反应;
②$\rm a$.$K$值越大,说明反应的正向程度越大,即转化率越高,$K$值越小,在相同条件下,平衡时$\rm X_{2}$的转化率逐渐降低,故$\rm a$正确;
$\rm b$.$\rm HF$、$\rm HCl$、$\rm HBr$、$\rm HI$的还原性依次增强,故$\rm b$错误;
$\rm c$.$\rm X_{2}$与$\rm H_{2}$反应的剧烈程度与$ K$的大小无直接联系,故$\rm c$错误;
$\rm d$.$ K$值越小,反应的正向程度越小,说明生成物越不稳定,越易分解,故$\rm d$正确。
某科研小组研究:其他条件不变,改变起始物氢气的物质的量对$\rm N_{2}(g)+3H_{2}(g)\rightleftharpoons \rm 2NH_{3}(g)$反应的影响$\rm ($正反应放热$\rm )$,实验结果如图所示:$\rm ($图中$T$表示温度,$n$表示物质的量$\rm )$
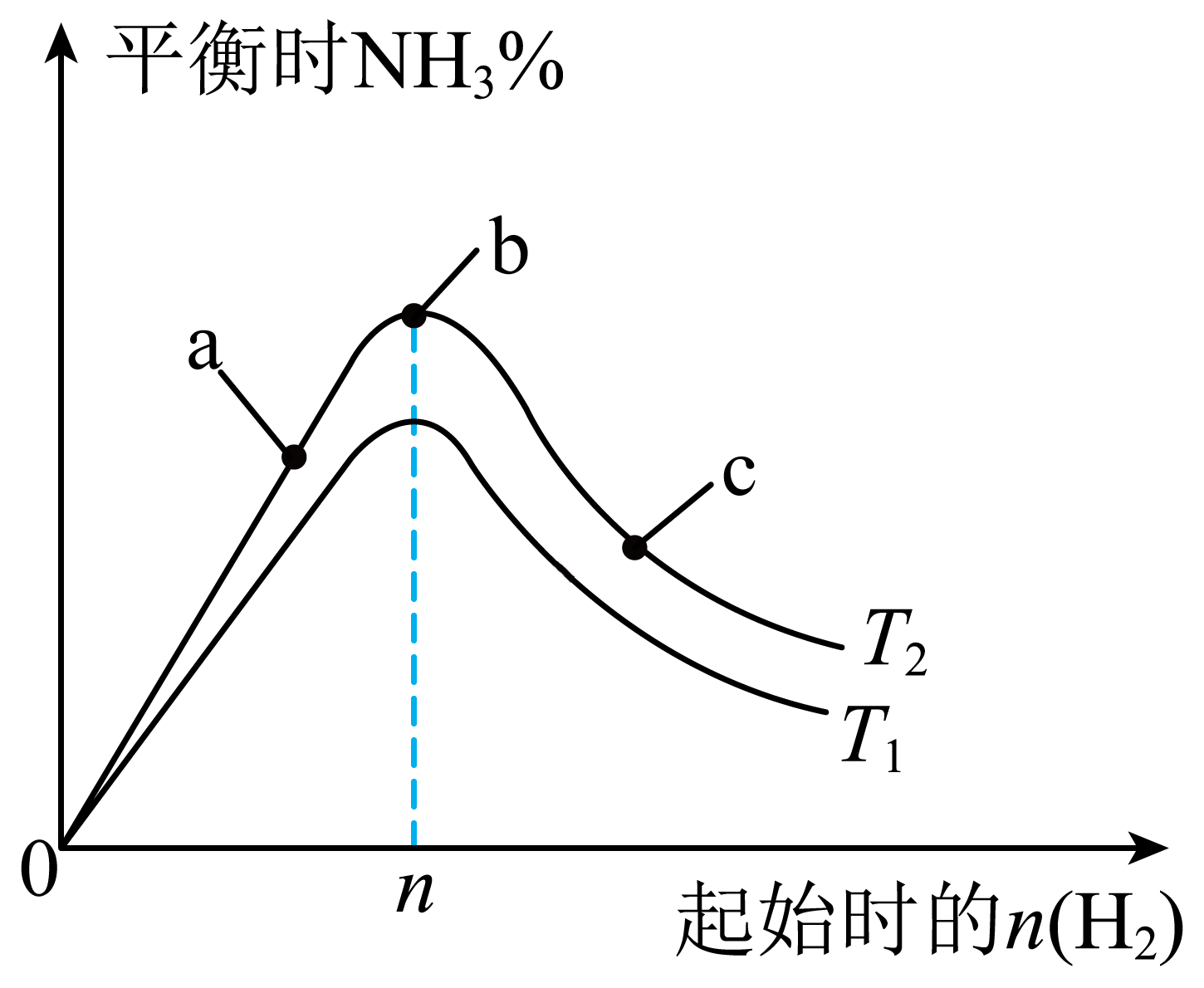
$T_{2}$温度下,$\rm a$点到$\rm b$点,随着起始时$n\rm (H_{2})$的增加,平衡时$\rm NH_{3}$的体积分数逐渐增加,原因是 。
$n\\rm (H_{2})$的增加,平衡正向移动,氮气的转化率增大,生成氨气的物质的量越多,平衡时$\\rm NH_{3}$的体积分数越大
"]]$n\rm (H_{2})$的增加,平衡正向移动,氮气的转化率增大,生成氨气的物质的量越多,平衡时$\rm NH_{3}$的体积分数越大;
| 化学反应热的计算题目答案及解析(完整版)
